
| A. | 对于元素周期表和元素周期律的发现有突出贡献的科学家是阿伏加德罗 | |
| B. | 元素周期表根据相对原子质量从小到大的顺序排列 | |
| C. | 现常见的元素周期表有七个横行,分为七个周期,有18个纵行,分为16个族 | |
| D. | 每一周期都是从金属元素开始,非金属元素结束 |
分析 A、对于元素周期表和元素周期律的发现有突出贡献的科学家是门捷列夫;
B、是按照原子核内质子数由少到多排列的;
C、根据元素周期表的结构;
D、第一周期是从非金属元素氢开始的.
解答 解:A、对于元素周期表和元素周期律的发现有突出贡献的科学家是门捷列夫,而不是阿伏加德罗,故A错误;
B、是按照原子核内质子数由少到多排列的,电子层数相同的放在同一周期,按原子序数由大到小,从左到右排列,故B错误;
C、元素周期表有18个纵行,分列16个族,即7个主族和7个副族、ⅤⅢ族和0族,故C正确;
D、第一周期是从非金属元素氢开始的,不是从金属开始的,故D错误;
故选C.
点评 本题考查长式元素周期表的结构,要求学生对元素周期表的组成特点要熟悉,周期表中周期与周期之间,族与族之间含有较多规律,在学习中要善于抓住这些规律会起到事半功倍的效果.


科目:高中化学 来源: 题型:解答题
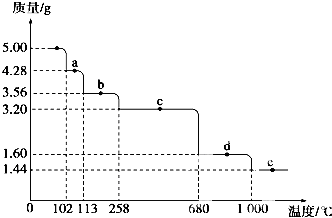 Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
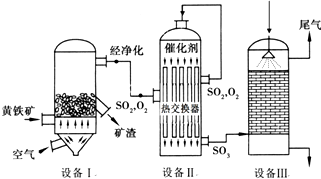
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

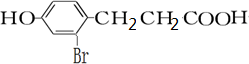 .
.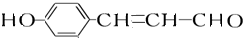 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$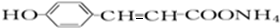 +2Ag↓+3NH3+H2O,反应类型为氧化反应.
+2Ag↓+3NH3+H2O,反应类型为氧化反应.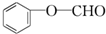 ,
,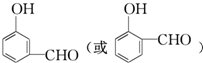 .
. +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:2Fe3++Cu=2Fe+Cu2+ | |
| D. | 碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是三种不同核素,互称为同位素,都属于氢元素 | |
| C. | X、Y两种元素的简单离子具有相同的电子层结构,则核电荷数大的元素离子半径小 | |
| D. | 18O中质子数与中子数不相等,但其和为18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鱼虾为了能长时间放置而不变质可以用适量福尔马林溶液浸泡 | |
| B. | “酸可除锈”是发生了化学变化,“洗涤剂可去油”是发生了物理变化 | |
| C. | 蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注入人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 煤酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com