
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
分析 C4Cl10可以看成C435Cl10的二元取代产物,其中37Cl可以取代35Cl原子;丁烷两种同分异构:一种是正丁烷的结构,所以C4Cl10也有2种结构:一种是四个碳原子一字排开的类似正丁烷结构、一种是类似异丁烷有支链的结构,据此回答.
解答 解:C4Cl10可以看成C435Cl10的二元取代产物,其中2个37Cl可以取代2个35Cl原子,C4Cl10也有2种结构,一种是四个碳原子一字排开的类似正丁烷结构,一种是类似异丁烷有支链的结构.四个碳原子一字排开的类似正丁烷结构的C4Cl10两个37Cl2在不同碳原子上的有4种,两个37Cl2在相同碳原子上的有2种,共计六种;类似异丁烷有支链的结构的C4Cl10两个37Cl2在不同碳原子上的有2种,在同一个碳原子上的有一种,共三种,所以C435Cl837Cl2的分子结构有9种.
故选C.
点评 本题考查学生有机物的同分异构体的书写知识,可以根据教材知识来回答,难度不大,注意解题方法的掌握可以节省解题时间.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
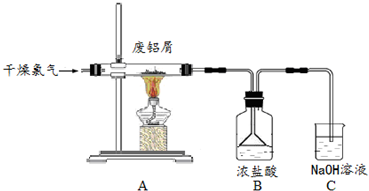
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
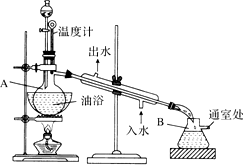 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com