
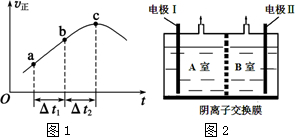
���� ��1������������������Ӧ�����Ҫ���Ŀ�귴Ӧ����������Ӧ����������������Ӧ�ļӼ���Ŀ�귴Ӧ����Ӧ������Ӧ�ı仯���ɣ�
��2���ٷ�Ӧ��ƽ��ĸ�����־��V��=V������c���ֻ��V�������ѣ�
���������ݾ��ȣ�SO2��g��+NO2��g��?NO��g��+SO3 ��g����H��0����Ӧ���ȣ����ڸ������м��룺��1molSO2��g����1molNO2��g������ʼ��Ӧ���ȣ����������м���II��1molSO3��g����1mol NO��g������ʼʱ��Ӧ���ȣ��ݴ˷���ƽ�ⳣ����
��3��ͨ��A�Ҳ�����N2����֪A���ĵ������ҺΪNaNO3��NaNO2�Ļ����Һ��NO2-��A���ŵ�ΪN2����AΪ��������B��Ϊ�������������ҺΪNaOH��Һ��OH-��B���ŵ磬�ݴ˷�����
��4�����NO�����ΪXL��NO2�����ΪYL������X+Y=6 ��
Ȼ����ݺͰ�����Ӧʱ��ʧ�������غ���У�2X+4Y=7��3 ��
����ʽ�������ɽ�ã�
��� �⣺��1����֪��2SO2��g��+O2 ��g��?2SO3 ��g����H=-196.6kJ•mol-1 ��
2NO��g��+O2 ��g��?2NO2 ��g����H=-113.0kJ•mol-1 ��
��$\frac{��}{2}$�ɵã�SO2��g��+NO2��g��?NO��g��+SO3 ��g����H=$\frac{-196.6KJ/mol}{2}$-$\frac{-113.0KJ/mol}{2}$=-41.6KJ/mol��������Ӧ�ȡ�H��0ʱ����Ӧ���ȣ�
�ʴ�Ϊ�����ȣ�
��2���ٻ�ѧƽ��״̬�ı�־�Ǹ����ʵ�Ũ�Ȳ��ٸı䣬��ʵ��������Ӧ���ʵ����淴Ӧ���ʣ�c���Ӧ������Ӧ������Ȼ���ڸı䣬��һ��δ��ƽ�⣬
�ʴ�Ϊ��δ����
���������ݾ��ȣ�SO2��g��+NO2��g��?NO��g��+SO3 ��g����H��0����Ӧ���ȣ����ڸ������м��룺��1molSO2��g����1molNO2��g������ʼ��Ӧ���ȣ��¶�����ƽ�����ƣ�K��С�����������м���II��1molSO3��g����1mol NO��g������ʼʱ��Ӧ���ȣ��¶Ƚ���ƽ�����ƣ�K���ʸ÷�Ӧ��ƽ�ⳣ����
�ʴ�Ϊ������
��3��ͨ��A�Ҳ�����N2����֪I���ĵ������ҺΪNaNO3��NaNO2�Ļ����Һ��NO2-��I�ŵ�ΪN2����AΪ��������II��Ϊ�������������ҺΪNaOH��Һ��OH-��II���ŵ磮
�ٵ缫IΪ����������B��ΪNaOH��Һ����II��Ϊ����������II���ŵ������������4OH--4e-=O2��+2H2O��������������Ϊ������
�ʴ�Ϊ��������O2��
��NO2-�������õ��ӱ���ԭΪ���������B�ҵ���Һ��������Һ���ʷŵ�ķ���ʽΪ��2NO2-+6e-+6H2O=8OH-+N2����
�ʴ�Ϊ��2NO2-+6e-+6H2O=8OH-+N2����
��4�����NO�����ΪXL��NO2�����ΪYL�����ݻ����������Ϊ6L������X+Y=6 ��
������Ӧʱ��NO��NO2�õ��ӣ�������ʧ���ӣ����ݵ�ʧ�������غ���У�2X+4Y=7��3 ��
����ʽ�������ɽ��X=1.5��Y=4.5������X��Y=1��3��
�ʴ�Ϊ��1��3��
���� ���⿼���˸�˹���ɵ�Ӧ�á���ѧƽ�ⳣ���Ĵ�С�Ƚ��Լ��绯ѧ֪ʶ�����ã��ۺ��Խ�ǿ���Ѷ����У�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ������Ҫ0.1mol/L NaOH��Һ480mL��0.5mol/L��������Һ500mL��������������Һ����������ش��������⣮
ʵ������Ҫ0.1mol/L NaOH��Һ480mL��0.5mol/L��������Һ500mL��������������Һ����������ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£�ȡŨ�Ⱦ�Ϊ0.01mol•L-1��HA��Һ��MOH��Һ��20mL���ֱ���0.01mol•L-1NaOH��Һ��0.01mol•L-1��������к͵ζ����ζ�������pH��μ���Һ������仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
�����£�ȡŨ�Ⱦ�Ϊ0.01mol•L-1��HA��Һ��MOH��Һ��20mL���ֱ���0.01mol•L-1NaOH��Һ��0.01mol•L-1��������к͵ζ����ζ�������pH��μ���Һ������仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | HA��MOH��Ϊ������� | |
| B�� | ����a�У��μ���Һ��20mLʱ��c��Cl-��=c��M+��=c��OH-��=c��H+�� | |
| C�� | ����b�У��μ���Һ��20mLʱ��c��Na+����c��A-����c��OH-����c��H+�� | |
| D�� | ����b�У��μ���Һ��10mLʱ��c��A-��+c��OH-��=c��H+��+c��HA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Ʒ�Ӧ������һ��Ϊ0.16 mol | |
| B�� | n��Na+����n��Cl-������Ϊ7��3 | |
| C�� | ����Ӧ��ת�Ƶĵ���Ϊn mol����0.15��n��0.25 | |
| D�� | n��NaCl����n��NaClO����n��NaClO3������Ϊ11��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.10mol H2O���к���ԭ����Ϊ0.3NA | |
| B�� | 1molCu��������Ũ���ᷴӦ������NA��SO3���� | |
| C�� | 0.10mol•L-1Na2CO3��Һ�к���Na+0.2NA | |
| D�� | 14g CO��N2�Ļ�������к��еķ�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �IJ����ͶȾ�Ϊ1�����нṹ��ʽΪ
�IJ����ͶȾ�Ϊ1�����нṹ��ʽΪ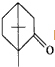 �����ʣ�ͨ��̼����ԭ�ӺͲ����Ͷȵļ��㣬ȷ�����������в����������ʵ�ͬ���칹����ǣ�������
�����ʣ�ͨ��̼����ԭ�ӺͲ����Ͷȵļ��㣬ȷ�����������в����������ʵ�ͬ���칹����ǣ�������| A�� | 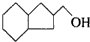 | B�� |  | C�� | 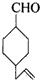 | D�� | 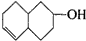 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol/L��5mol/L | B�� | 3mol/L��5mol/L | C�� | 1mol/L��3mol/L | D�� | 3mol/L��7mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol���ڵ�KHSO4�к���2 NA�������� | |
| B�� | 1 L 0.1 mol/LCH3COONa��Һ�У�����������С��0.1 NA | |
| C�� | ��״���£�6.72 L NO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0.1NA | |
| D�� | �볣�³�ѹ��17g H2O2�����Ǽ��Լ���Ŀ��ͬ��N2H4�ķ�������Ϊ0.5NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com