
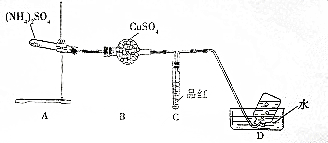
分析 (1)无水硫酸铜与水反应生成蓝色的硫酸铜晶体,通常用来检测水的生成;二氧化硫具有漂白性;
(2)依据氧化还原反应得失电子守恒判断;
(3)依据硫酸根离子检验方法解答.
解答 解:(1)无水硫酸铜与水反应生成蓝色的硫酸铜晶体,通常用来检测水的生成,所以B装置的作用是检验水的生成;二氧化硫具有漂白性,若C中品红溶液褪色,可证明有二氧化硫生成,故答案为:检验水的生成;品红溶液褪色;
(2)硫酸铵受热分解检验生成了SO2,则反应中硫酸根离子中等硫化合价降低,依据氧化还原反应得失电子守恒,需要有化合价升高的元素,依据题意最终气体能够用排水法收集,可知该气体为氮气,反应中氨气中-3价的氮元素化合价升高为氮气中的0价;
故答案为:氮气;
(3)要检验白色粉末中不含SO42-,正确的操作为:取白色粉末少许,放入试管加水溶解,然后加入足量的盐酸,若无明显现象,再加入氯化钡溶液,如果产生白色沉淀,则含有硫酸根离子,如果不产生白色沉淀,则证明不含硫酸根离子;
故答案为:取白色粉末少许,放入试管加水溶解,然后加入足量的盐酸,若无明显现象,再加入氯化钡溶液,如果产生白色沉淀,则含有硫酸根离子,如果不产生白色沉淀,则证明不含硫酸根离子.
点评 本题考查了物质的检验,明确氧化还原反应规律,熟悉二氧化硫、硫酸根离子的性质是解题关键,注意离子检验的严密性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | (2)(3)(4) | C. | (1)(2)(3)(5) | D. | (2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol Na2CO3和1mol NaOH | B. | 1mol Na2CO3和0.6mol NaOH | ||
| C. | 0.8mol Na2CO3和1mol NaOH | D. | 只有1mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐及氧化物都是电解质 | |
| B. | 电解质溶液能导电是因为发生了电离,产生了自由移动的离子 | |
| C. | 电解质不一定能导电,能导电的物质不一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
下列有关物质性质的应用的说法正确的是
A.金属活泼性铜比铁弱.可在铁船闸上装铜块减缓其腐蚀
B.MgO的熔点很高,可用于制作耐高温材科
C.铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁
D.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:选择题
下列A—D四组,每组有两个反应,其中两个反应能用同一离子方 程式表示的是( )
程式表示的是( )
(Ⅰ) | (Ⅱ) | |
A | 少量H2SO4滴入Ba(OH)2溶液中 | 少量NaHSO4滴入Ba(OH)2溶液中 |
B | 少量NaOH滴入Al2(SO4)3溶液中 | 少量Al2(SO4)3溶液滴入氨水中 |
C | 少量SO2通入Ba(NO3)2溶液中生成白色沉淀 | 少量SO2通入Ba(OH)2溶液中生成白色沉淀 |
D | 0.1 mol Cl2通入含0.2 mol FeBr2的溶液中 | 0.1 mol Cl2通入含0.2 mol FeCl2的溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com