


 4NO + 6H2O (2分)
4NO + 6H2O (2分)

科目:高中化学 来源:不详 题型:单选题
| A.研制高温下活性较大的催化剂 |
| B.寻求NH3的新来源 |
| C.研制低温下活性较大的催化剂 |
| D.研制耐高温高压的新型材料建造合成塔 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
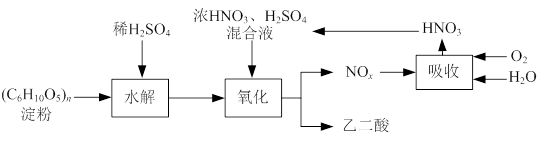
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2 H2O的一种新工艺流程如下图:
H2O的一种新工艺流程如下图: 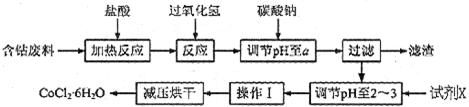
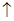
| 沉淀物 | 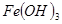 | 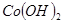 | 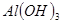 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
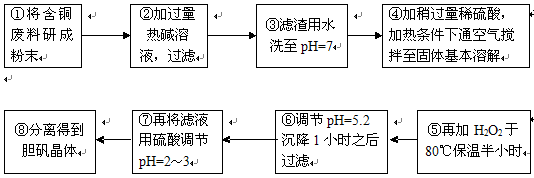
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.②③④ | C.①③⑤ | D.②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com