
| 0.672L |
| 22.4L/mol |
| 1.04g/mL×24.04mL×3.2% |
| 40g/mol |
| 126g/mol×0.01mol |
| 4.76g |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,46gNO2和N2O4的混合物含有的氮原子数为NA |
| B、标准状况下,22.4L NH3溶于足量水中产生的NH4+数目为NA |
| C、标准状况下,22.4L SO3所含的分子数为NA |
| D、通常状况下,56 g Fe与任何物质完全反应时转移的电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层电子排布为1s2的原子和最外层电子排布为2s2的原子,所对应的两元素一定在同一主族 |
| B、3p能级上有1个空轨道的原子和4p能级上有1空轨道的原子,所对应的两元素一定在同一主族 |
| C、最外层电子排布为nsnnpn的原子和最外层电子排布为2s22p6的离子,所对应的两元素一定在同一周期 |
| D、原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子,所对应的两元素一定在同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3的酸性比HClO的酸性弱 |
| B、CH4、NH3、H2O、HF的热稳定性依次逐渐增强 |
| C、铍(Be)的原子失去电子能力比钙强 |
| D、硫、硒(Se)为同主族元素,非金属性Se比S弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它的元素符号为O |
| B、它的核外电子排布式为1s22s22p63s23p4 |
| C、可以与H2化合生成液态化合物 |
D、其原子轨道式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
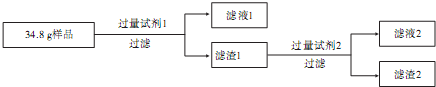
| 试剂1 | 试剂2 | 滤渣1质量 | 滤渣2质量 | |
| 实验一 | 稀盐酸 | NaOH溶液 | 12.4g | 6.4g |
| 实验二 | NaOH溶液 | 稀盐酸 | 28.8g | 6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com