
分析 结合物质的性质进行判断,四种物质中,碳酸氢钠不稳定,易分解产生CO2,Na2O2能与水反应生成氧气,Al2O3难溶于水,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,以此解答.
解答 解:4种物质::①Na2O2②Al2O3③NaHCO3④Ca(ClO)2.其中,受热分解产生CO2的是碳酸氢钠受热分解生成,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,Na2O2能与水反应生成氧气,2Na2O2+2H2O=4NaOH+O2;Al2O3难溶于水,可由氯气与冷的消石灰反应制得的是漂白粉,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:③,①,②,④.
点评 本题综合考查元素化合物知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 相同温度下,将足量氯化银固体分别加入:①蒸馏水、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1盐酸、④0.1 mol•L-1硝酸银溶液中,充分溶解后Ag+浓度:①>③=④>② | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
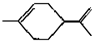 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 它不能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为液态,易溶于水 | |
| C. | 分子式为C10H16 | |
| D. | 与过量的溴的CCl4溶液反应后产物为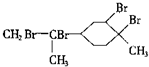 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
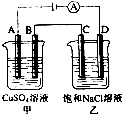 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )
如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )| A. | 甲烧杯中B极上最多可析出铜0.64g | |
| B. | 甲烧杯中A极上电极反应式4OH--4 e-═2H2O+O2↑ | |
| C. | 烧杯中D极上电极反应式为4H++4 e-═2H2↑ | |
| D. | 乙烧杯中滴入酚酞试液,C极附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2气体通入石灰水中:CO2+Ca(OH)2═CaCO3↓+H2O | |
| B. | 钠被氧气氧化:4Na+O2═2Na2O | |
| C. | CO气体通过灼热的CuO:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | |
| D. | NH3通入硝酸溶液中:NH3+HNO3═NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com