
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程。
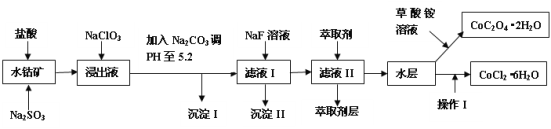
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出过程中Co2O3发生反应的离子方程式为___。
(2)在浸出液中加入NaClO3的作用是___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀II的主要成分___。
(4)操作I中包括蒸发浓缩的过程,在蒸发浓缩之前应先向溶液中加入_______(填试剂名称)。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥、称重。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49 g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则在150℃~210℃温度范围放出的气体物质是_______,290℃~320℃温度范围,剩余的固体物质化学式为________。
[已知:CoC2O4·2H2O的摩尔质量为183 g/mol]
【答案】Co2O3+SO32-+4H+=2Co2++SO42-+2H2O 将亚铁离子氧化为铁离子 使Fe3+和Al3+沉淀完全 CaF2和MgF2 盐酸 产品中结晶水含量低或产品中混有氯化钠杂质 H2O Co3O4或者CoO·Co2O3
【解析】
含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则进入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去Ca2+、Mg2+,过滤后,向滤液中加入萃取剂,将Mn2+萃取,萃取后的余液中主要含有CoCl2,蒸发浓缩,冷却结晶,过滤等操作得到氯化钴晶体,若加入草酸铵溶液蒸发浓缩冷却结晶、过滤洗涤、干燥得到草酸钴晶体,以此解答该题。
(1)浸出液含有Co2+,故Co2O3在酸性条件下被SO32-还原,反应的离子方程式:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)由于Fe2+需转化为Fe3+方可通过调节溶液pH水解而除去,故在浸出液中加入NaClO3的作用是在酸性条件下将Fe2+氧化为Fe3+;
(3)pH至5.2, Fe3+和Al3+都可以形成金属氢氧化物沉淀,且沉淀完全,故加入Na2CO3调pH至5.2,目的是使Fe3+和Al3+都沉淀完全;此时溶液中未除掉离子还有Mn2+、Mg2+、Ca2+(硫酸钙微溶于水,此时溶液中仍含Ca2+),而萃取剂层含锰元素,故应该加入NaF溶液,为除掉Mg2+、Ca2+,生成的沉淀II主要成分是CaF2和MgF2;
(4)操作I中包括蒸发浓缩的过程,在蒸发浓缩之前,为抑制CoCl2的水解,应先向溶液中加入浓盐酸调整溶液pH为2~3;
(5)粗产品中CoCl2·6H2O质量分数大于100%,即Cl-含量偏高,原因可能是因减压烘干使CoCl26H2O的结晶水减少,则产品中结晶水含量低,测得的CoCl26H2O质量分数与实际值相比偏高;或粗产品中含有杂质NaCl,导致Cl-含量偏高,也会使CoCl26H2O质量分数偏高;
(6)5.49 g晶体物质的量n=![]() =0.03 mol,结晶水完全失去物质的量应为0.06 mol,此时固体质量变化△m=0.06 mol×18 g/mol=1.08 g,根据图表数据可知,150~210℃固体质量变化=5.49g-4.41g=1.08g,说明在150℃~210℃温度范围放出的气体物质是H2O;210℃失去结晶水得到CoC2O4,210~290℃过程中是CoC2O4发生的反应,210~290℃过程中产生的气体只有CO2,依据C元素守恒得到生成CO2物质的量为0.06 mol,质量=0.06 mol×44 g/mol=2.64 g,气体质量共计减小=4.41 g-2.41 g=2 g,说明不是分解反应,参加反应的还有氧气,则反应的氧气质量=2.64 g-2 g=0.64 g,反应的O2物质的量n(O2)=
=0.03 mol,结晶水完全失去物质的量应为0.06 mol,此时固体质量变化△m=0.06 mol×18 g/mol=1.08 g,根据图表数据可知,150~210℃固体质量变化=5.49g-4.41g=1.08g,说明在150℃~210℃温度范围放出的气体物质是H2O;210℃失去结晶水得到CoC2O4,210~290℃过程中是CoC2O4发生的反应,210~290℃过程中产生的气体只有CO2,依据C元素守恒得到生成CO2物质的量为0.06 mol,质量=0.06 mol×44 g/mol=2.64 g,气体质量共计减小=4.41 g-2.41 g=2 g,说明不是分解反应,参加反应的还有氧气,则反应的氧气质量=2.64 g-2 g=0.64 g,反应的O2物质的量n(O2)=![]() =0.02 mol;n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,依据原子守恒配平书写反应的化学方程式为3CoC2O4+2O2
=0.02 mol;n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,依据原子守恒配平书写反应的化学方程式为3CoC2O4+2O2![]() Co3O4+6CO2,故290℃~320℃温度范围,剩余的固体物质化学式为产物为Co3O4或者CoOCo2O。
Co3O4+6CO2,故290℃~320℃温度范围,剩余的固体物质化学式为产物为Co3O4或者CoOCo2O。


科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述不正确的是
A.分子式为C4H8O2的酯有4种结构
B.主链含5个碳原子,有甲基、乙基2个支链的烷烃有3种
C.丙烯分子中最多有7个原子共平面
D.乙烯和溴的四氯化碳溶液反应生成1,2二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法中正确的是( )
①该化合物仅含碳、氢两种元素 ②该化合物中碳、氢原子个数比为1∶4
③无法确定该化合物是否含有氧元素 ④该化合物中一定含有氧元素
A. ①②B. ②④C. ③④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,某些反应与平衡常数数值如下:
2NO(g)![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是( )
A.常温下,水分解产生O2,此时平衡常数的值约为5×10-80
B.常温下,最易分解放出O2的是水
C.K3=![]()
D.以上都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)],已知该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的是( )
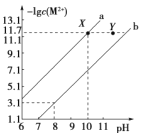
A.a线表示Fe(OH)2饱和溶液中的变化关系
B.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
C.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
D.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中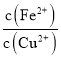 =104.6
=104.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料发生如图所示的变化,可以合成高聚物G。
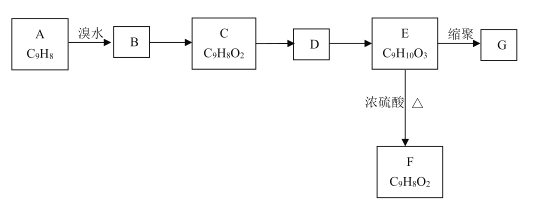
已知:①两个羟基连在同一碳原子上不稳定,会自动脱水。
②C能发生银镜反应,F能使溴水褪色。
回答下列问题:
(1)A中官能团的名称是________;C的结构简式为_________。
(2)B→C的反应条件是________,E→F的反应类型是_________。
(3)写出E→G的化学方程式________。
(4)E的同分异构体中,苯环上有4个取代基、遇FeCl3溶液显紫色且能与碳酸氢钠溶液反应的共有________种(不考虑立体异构)。其中核磁共振氢谱显示有4组峰的结构简式为________(写出一种即可)。
(5)参照上述合成路线,设计以丙炔为原料制备乳酸(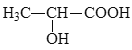 )的合成路线________(无机试剂任选)。
)的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
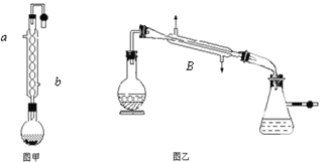
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
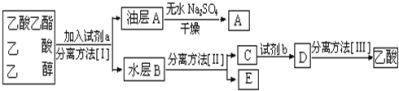
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向![]() 、
、![]() 的饱和溶液中滴加少量
的饱和溶液中滴加少量![]() 溶液,溶液中
溶液,溶液中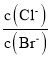 不变
不变
B.向![]() 的
的![]() 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中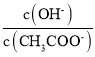 增大
增大
C.![]() 被完全还原为
被完全还原为![]() 时,转移的电子数约为
时,转移的电子数约为![]()
D.一定条件下,反应![]() 能自发进行,该反应的
能自发进行,该反应的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com