
【题目】SO2是我国大部分地区雾霾天气产生的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。SO2主要来自于汽车尾气、燃煤烟气、硫酸工业尾气、冶金工业烟气等。
(1)“催化转换器”能将汽车尾气中CO与NO转化成可参与大气生态环境循环的无毒气体,并促进烃类充分燃烧及SO2的转化,但也在一定程度上提高了空气的酸度。“催化转换器”提高空气酸度的原因是_____________________________。
(2)用氨水将燃煤烟气中的SO2转化成NH4HSO3。该法是利用了SO2________(填选项字母编号)
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物性质
(3)用生物质热解气(主要成分CO、CH4、H2)将燃煤烟气中SO2在高温下还原成单质硫。主要发生了下列反应:
2H2(g) +SO2(g)= S(g) + 2H2O(g) △H1 = + 90.4kJmol-1
2CO(g) +O2(g)= 2CO2(g) △H2 = - 566.0kJmol-1
S(g) +O2(g)= SO2(g) △H3 = - 574.0kJmol-1
试写出CO将SO2还原成S(g)的热化学方程式__________________________。
(4)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):
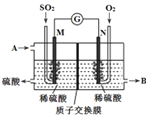
①溶液中的H+移向_______。(填“M”或“N”)
②M极发生的电极反应式为________________。
③写出A、B所代表的物质的化学式:
A_______、B ________。
(5)利用硫酸钠溶液吸收冶金工业烟气中SO2,再用惰性电极电解,能获得所需的产品,装置如图所示。
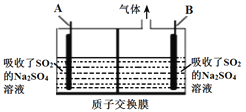
①若电解后A极区得到硫酸,则B电极反应式为________________________。
②若电解后A极区析出硫磺,则电解反应的化学方程式为________________。
【答案】 催化转换器将SO2转化成了SO3,在空气中生成了H2SO4液滴 D 2CO(g) +SO2(g)= S(g) + 2CO2(g) △H= + 8.0kJmol-1 N SO2 + 2H2O -2e- =SO42- + 4H+ H2O H2O 2H+ + 2e- = H2↑ SO2 ![]() S + O2↑
S + O2↑
【解析】(1)由于“催化转化器”促进了SO2的转化,生成的SO3增多,SO3+H2O=H2SO4,提高了空气的酸度,故答案为:催化转换器将SO2转化成了SO3,在空气中生成了H2SO4液滴;
(2)氨水吸收燃煤烟气中的SO2转化为NH4HSO3,反应离子方程式为:NH3+SO2+H2O=NH4++HSO3-,该反应体现了二氧化硫酸性氧化物的性质,故答案为: D;
(3)①2H2(g) +SO2(g)= S(g) + 2H2O(g)△H1 = + 90.4kJ/mol,②2CO(g) +O2(g)= 2CO2(g) △H2 =-566.0kJ/mol,③S(g) +O2(g)= SO2(g) △H3 =-574.0kJ/mol
根据盖斯定律,将②-③得2CO(g) +SO2(g)= S(g) + 2CO2(g) △H=(-566.0kJ/mol)-(-574.0kJ/mol)=+ 8.0kJmol-1,故答案为:2CO(g) +SO2(g)= S(g) + 2CO2(g) △H= + 8.0kJmol-1;
(4)①硫酸工业尾气中的SO2经分离后,可用于制备硫酸,是二氧化硫失电子得到硫酸根的氧化反应过程,该反应过程是原电池负极发生的反应,所以M是负极,则N为正极。在原电池中,阳离子向正极移动,故答案为:N;
②该电极上SO2被氧化生成SO42-,负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+;
③根据负极的电极反应可知,A为水;正极上的电极反应式为O2 + 4e-- + 4H+ == 2H2O,因此 B为水,故答案为:H2O;H2O;
(5)①若电解后A极区得到硫酸,则发生二氧化硫被氧化为硫酸的反应,因此A为阳极,则B为阴极,电极反应式为2H+ + 2e- = H2↑,故答案为:2H+ + 2e- = H2↑;
②若电解后A极区析出硫磺,则发生二氧化硫被还原为硫的反应,则B为阳极,发生氧化反应,水中氢氧根离子失去电子生成氧气,电解反应的化学方程式为SO2 ![]() S + O2↑,故答案为:SO2
S + O2↑,故答案为:SO2 ![]() S + O2↑。
S + O2↑。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 煤和石油都是可再生资源 B. 分离煤焦油可以获取苯
C. 石油的裂化仅能得到烷烃 D. 煤的气化和石油的分馏都属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色透明溶液中能大量共存的离子组是
A. Na+、Al3+、HCO3-、NO3- B. AlO2-、Cl-、Mg2+、K+
C. NH4+、Na+、CH3COO-、NO3- D. Na+、NO3-、ClO-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组利用废旧铝铜合金(含有少量杂质铁)制备Al(OH)3,流程如下:

回答下列问题:
(1)铝铜合金很坚硬,轻而抗张强度大,可代替昂贵的铜线为电线。但该合金暴露在空气中易被腐蚀,原因是___________________________。
(2)废旧铝铜用过量的稀硫酸浸取时,发生反应的化学方程式为________________。
(3)能溶解滤渣A而不产生空气污染的方法是___________________。
(4)在温度为358~368K时,加入Al2O3调节pH=1.6~1.8,析出黄铁矾[Na2Fe6(SO4)4(OH)12]。写出析出黄铁矾的离子方程式
(5)加NH3·H2O后将沉淀经过滤、_________、_________称量,得Al(OH)3质量为废旧铝铜合金质量的2.6 倍,则废旧铝铜合金含中Al的质量分数≤________%。
(6)Al(OH)3是塑料和有机聚合物的一种理想的阻燃剂填充料。塑料或聚合物与外部热源接触而燃烧时,可分为以下几个阶段:①加热,②分解,③起火,④燃烧,⑤蔓延。Al(OH)3阻燃起作用的阶段是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K 是无色气体,是主要的大气污染物之一。0.05 mol/L丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是
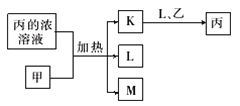
A. K、L、M 中沸点最高的是M
B. 元素的非金属性:Z>Y>X
C. 原子半径:W<X<Y
D. 丙也可由W、Y组成的某化合物与K直接反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
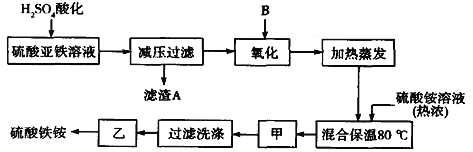
请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是_________,滤渣A的主要成分是________。
(2)下列物质中最适合的氧化剂B是______(填字母);反应的离子方程式___________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲名称分别是:甲______________,乙为常温晾干。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为__(写化学式),能否用酸性的KMnO4溶液?_________填“能”或“否”)理由是:_______。(可用语言或方程式说明)
(5)称取14.00 g样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba(NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d,呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
a(干燥气体) | b(液体) |
| |
A | NO | 水 | |
B | CO2 | 4molL﹣1NaOH溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 热的浓的NaOH溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com