
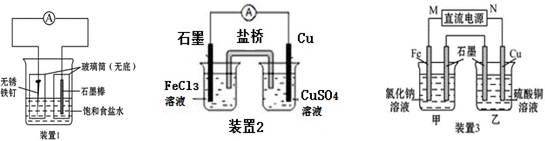
| ||
| ||
| 0.64g |
| 64g/mol |
| 22.4L×0.02mol |
| 2mol |


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol?L-1 |
B、 图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时, △H<0,若使用正催化剂,E值会减小 |
C、 图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
D、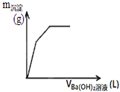 图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池Zn为负极,发生还原反应 |
| B、该电池的正极反应为MnO2+e-+H2O=MnO(OH)+OH- |
| C、放电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn |
| D、电池工作时OH-通过薄层纸片向附着二氧化锰的电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NH4HSO4 |
| C、CH3COONH4 |
| D、(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
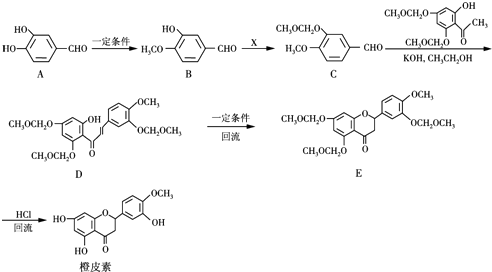
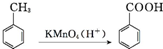 ,结合流程信息,写出以甲苯和上述流程中的“X”为原料,制备
,结合流程信息,写出以甲苯和上述流程中的“X”为原料,制备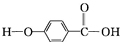 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+ |
| B、Cu2+ |
| C、Mg2+ |
| D、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将10mL 18mol/L H2SO4溶液加入盛有90mL水的容量瓶中 |
| B、将10mL 18mol/L H2SO4溶液加入容量瓶中,加水至刻度线 |
| C、加水时不慎超过刻度线,立即用胶头滴管吸出多余液体 |
| D、定容时仰视刻度线,配置的溶液浓度偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com