
| A. | 2x | B. | 4 | C. | $\frac{y}{2}$ | D. | 7 |
分析 反应xR2++yH++O2=mR3++nH2O中,R的化合价升高,被氧化,O的化合价降低,被还原,根据氧化还原反应得失电子数目相等配平化学方程式,可求m值.
解答 解:解法一:反应xR2++yH++O2=mR3++nH2O中,R的化合价有+2价升高为+3价,被氧化,O的化合价由0价降低降低到-2价,被还原,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,可配平反应的方程式为4R2++4H++O2=4R3++2H2O,
则m=4,
解法二:由质量守恒可得x=m,
由氧化还原反应得失电子守恒可得2×(2-0)=m×(3-2),
m=4,
故选B.
点评 本题考查氧化还原反应的计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,难度不大,注意从质量守恒和得失电子的角度解答,或直接配平方程式,也可得出m…


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:解答题
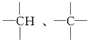 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
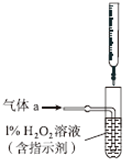 硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
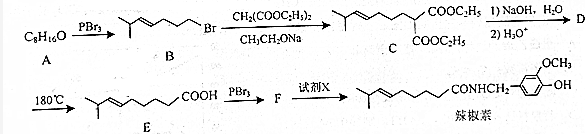
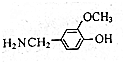 ,由B→C的反应类型是取代,
,由B→C的反应类型是取代,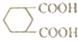 的合成路线流程图(无机试剂任用,上述流程中出现的试剂可用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$^CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任用,上述流程中出现的试剂可用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$^CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的CH3COOH溶液和pH=10的KOH溶液等体积混合:2c(K+)+c(H+)=c(OH-)+c(CH3COOH)+2c(CH3COO-) | |
| B. | 向0.10mol/LNaHSO3溶液中通入NH3至溶液pH=7 (体积变化可忽略):c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 0.3mol的SO2通入1L0.4mol/L的NaOH溶液中:4c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3) | |
| D. | 0.1mol/L的HF溶液和0.1mol/L的NaOH溶液等体积混合:c(Na+)+c(OH-)>c(H+)+c(F-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的一元取代物没有同分异构体 | B. | 苯的邻位二元取代物只有一种 | ||
| C. | 苯的间位二元取代物只有一种 | D. | 苯的对位二元取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许. | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量. | |
| 3 | 静置,将甲中上层清液注入乙中 | 若产生白色沉淀,则甲是Na2SO3溶液,乙是稀H2SO4. 若乙试管中沉淀溶解且放出有刺激性气味的气体,则甲是稀H2SO4,乙是Na2SO3溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | NaH2PO4═Na++H2PO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com