
| A、Cl2+2Fe2+═2Fe3++2Cl- |
| B、Cl2+2Br-═Br2+2Cl- |
| C、3Cl2+2Fe2++4Br-═2Fe3++2Br2+2Cl- |
| D、Cl2+2Fe2++2Br-═2Fe3++Br2+4Cl- |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、0.1mol?L-1 |
| B、0.01mol?L-1 |
| C、0.2mol?L-1 |
| D、0.02mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性溶液中:ClO-、NH4+、SO42-、Na+ |
| B、1.0mol?L-1的NaAlO2溶液中:Cl-、HCO3-、K+、Ca2+ |
| C、在强碱性环境中:AlO2-、SiO3 2-、Na+、K+ |
| D、无色溶液中:NO3-、MnO4-、Al3+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、中子数为146、质子数为92 的铀(U)原子
| ||
| B、CO2的电子式:O::C::O | ||
C、乙醇分子的比例模型: | ||
| D、乙酸溶于水的电离方程式:CH3COOH?H++CH2COOH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 15 | 20 | 10 | 15 | t1 |
| ② | a | 30 | 0 | 15 | t2 |
| ③ | 15 | b | c | 30 | t3 |
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| ④ |
| ⑤ |
| 500℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
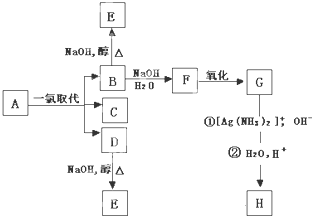
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com