
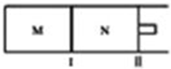
 ��ͼ��ʾ������I�̶�����������II�������ƶ���M��N���������о�������Ӧ��A��g��+2B��g��?xC��g������M��N��ͨ��1mol��2molB�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ���ǣ�������
��ͼ��ʾ������I�̶�����������II�������ƶ���M��N���������о�������Ӧ��A��g��+2B��g��?xC��g������M��N��ͨ��1mol��2molB�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ���ǣ�������| A�� | ��x=3���ﵽƽ���A�����������ϵΪ���գ�M�����գ�N�� | |
| B�� | ��x��3��C��ƽ��Ũ�ȹ�ϵΪ��c��M����c��N�� | |
| C�� | ��x��3���ﵽƽ���B��ת���ʹ�ϵΪ������M��������N�� | |
| D�� | x����Ϊ��ֵ��ƽ��ʱM��N�е�ƽ����Է������������ |
���� ����M�����Ǻ��º����½�����ƽ�⣬N�����Ǻ��º�ѹ�½�����ƽ�⣬
A����x=3�����ڷ�Ӧǰ������������䣬N����������ƽ������º����½�����ƽ���Ч��
B����x��3�����ڷ�Ӧ�����������С��N����������ƽ���൱�ں��º����½�����ƽ����С���������ѹǿ����ƽ�������ƶ���
C����x��3�����ڷ�Ӧ�������������N����������ƽ���൱�ں��º����½�����ƽ���������������ѹǿ��С��ƽ�������ƶ���
D��ƽ����Է�������$\overline{M}$=$\frac{m}{n}$����Ӧǰ�������壬m���䣬��xȡ����ֵ��M��N��ƽ��״̬���ܲ�ͬ��n���ܲ���ȣ�
��� �⣺M�����Ǻ��º����½�����ƽ�⣬N�����Ǻ��º�ѹ�½�����ƽ�⣬
A����x=3�����ڷ�Ӧǰ������������䣬N����������ƽ������º����½�����ƽ���Ч�����Դﵽƽ���A�����������ϵΪ���գ�M��=�գ�N������A����
B����x��3�����ڷ�Ӧ�����������С��N����������ƽ���൱�ں��º����½�����ƽ����С���������ѹǿ����ƽ�������ƶ���C��ƽ��Ũ����������C��ƽ��Ũ�ȹ�ϵΪ��c��M����c��N������B��ȷ��
C����x��3�����ڷ�Ӧ�������������N����������ƽ���൱�ں��º����½�����ƽ���������������ѹǿ��С��ƽ�������ƶ���B��ת�����������Դﵽƽ���B��ת���ʹ�ϵΪ������M��������N������C����
D����x=3��M��N��ƽ��״̬��ͬ��ƽ��ʱM��N�е�ƽ����Է�����������ȣ���x��3��3�����ߵ�ƽ��״̬��ͬ��ƽ��ʱM��N�е�ƽ����Է����������ȣ���D����
��ѡB��
���� ���⿼��ѧ��Ӱ�컯ѧƽ���ƶ������أ�ע����º����µ�ƽ������º�ѹ�µ�ƽ���Ĺ�ϵ�Լ���Чƽ����жϣ�DΪ�״��㣬��Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ���������CO��CH4�����������Ϊ33.9% | |
| B�� | ԭ��������У�C2H4��C2H2�������Ϊ1.9L | |
| C�� | ��Ӧ��ɺ�����ˮ������Ϊ9g | |
| D�� | ԭ��������У�CO��CH4�������һ��Ϊ1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��ҺA�е�������ΪFe2+��Fe3��H+ | B�� | ��Ʒ�н���Fe������Ϊ4.48g | ||
| C�� | ��Ʒ��CuO������Ϊ4.0 | D�� | V=448 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Na2O��CaO��Al2O3��H2O | B�� | �NaOH��KOH��Ba��OH��2��Na2CO3 | ||
| C�� | �����Fe2O3��NO��SO2��CuO | D�� | �H2SO4��HNO3��NaHSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ڢۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1����2����3����4����5�� | B�� | ��4����5����7���� | C�� | ��4����5�� | D�� | ��3����4����5����7�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ﵽ��ѧ��Ӧ��ʱ��������2mol NH3 | |
| B�� | ���������ټ���N2�����Լӿ췴Ӧ���� | |
| C�� | �����¶ȿ��Լӿ췴Ӧ���� | |
| D�� | 1mol N2 ��3mol H2������������2mol NH3�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com