
【题目】元素的化学性质主要取决于下列的( )
A.最外层电子数
B.核外电子数
C.质子数
D.中子数
科目:高中化学 来源: 题型:
【题目】水仙花所含的挥发油中含有丁香油酚、苯甲醇、苯甲醛、桂皮醇等成分。它们的结构简式如下:
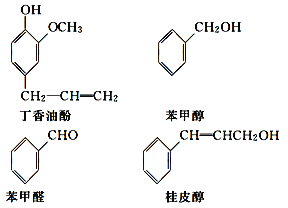
请回答下列问题:
(1)①丁香油酚中含氧的官能团是_____;丁香油酚可能具有的性质是_____(填字母)。
A.可与烧碱反应
B.只能与Br2发生加成反应
C.既可燃烧,也可使酸性KMnO4溶液褪色
D.可与NaHCO3溶液反应放出CO2气体
②从结构上看,上述四种有机物中与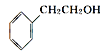 互为同系物的是____(填名称)。
互为同系物的是____(填名称)。
(2)苯甲醛经________(填反应类型)反应可得到苯甲醇。写出苯甲醛和银氨溶液反应化学方程式为___________________________________。
(3)由桂皮醇转化为丙的过程为(已略去无关产物)
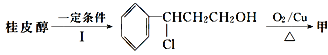
![]() 乙
乙![]() 丙
丙
如果反应Ⅱ为消去反应,则反应Ⅱ的条件是_______________,反应Ⅲ为加聚反应,则高聚物丙的结构简式为 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图一装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A (A下端活塞关闭)中。
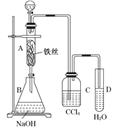
(1)写出A中反应的化学方程式________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式___________________。
(3)C中盛放CCl4的作用是____________________。
(4)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入___________,现象是_______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH ⑧盐酸。其中能导电的是__________,(填序号,下同),属于电解质的是___________,属于非电解质的是___________。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系是________
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为______;若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种综合性能优良的陶瓷材料,能缓慢水解,不耐酸碱腐蚀。某小组探究在实验室制备AlN并测定产品纯度,设计实验如下。请回答:
Ⅰ.制备AlN
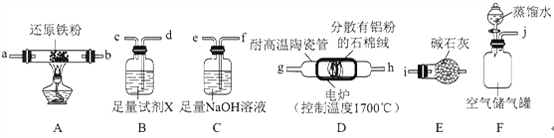
(1)实验时,以空气为原料制备AlN。按气流由左向右的方向,上述装置的正确连接顺序为j→________→i(填仪器接口字母编号)。
(2)上述装置中,需要检漏的仪器名称为________。
(3)试剂X的作用为________。
(4)装置D中发生反应的化学方程式为________。
Ⅱ.测定产品纯度
(5)设计实验证明:装置D的产品中含有Al单质________。
(6)测定产品纯度:取装置D中产品4.37g,加入足量NaOH浓溶液;通入水蒸气,将生成的气体全部蒸出,用V1mLc1mol·L-1的盐酸吸收;以酚酞作指示剂,用c2mol·L-1的NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗V2mLNaOH标准溶液。则:
①达到滴定终点的现象为________。
②产品中A1N的质量分数为________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是( )
A.乙烯通入酸性高锰酸钾溶液中,溶液褪色
B.苯滴入溴水中,振荡后溴水层接近无色
C.甲烷和氯气混合后,放置在光亮的地方,混合气体颜色逐渐变浅
D.将裂化获得的汽油滴入溴水中,溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 含有非极性键的分子一定是非极性分子
B. 非极性分子中一定含有非极性键
C. 由极性键形成的双原子分子一定是极性分子
D. 两个原子之间共用两对电子,形成的化学键一定有极性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是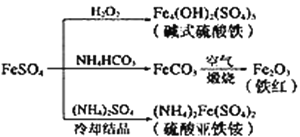
A. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检测明矾样晶(含砷酸盐)中的砷含量是否超标,实验装置如下图所示(夹持装置已略去)。
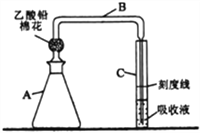
【实验1】配制砷标准溶液
①取0.132gAg2O3,用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1mL相当于0.10mg砷);
②取一定量上述溶液,配制1L含砷量为1mg·L-1的砷标准溶液。
(1)步骤①中,必须使用的玻璃仪器除烧杯、玻璃棒外,还有__________。步骤②需取用步骤①中Na3AsO3溶液____mL。
【实验2】制备砷标准对照液
①往A瓶中加入2.00mL砷标准溶液,再依次加入一定量的盐酸、KI溶液和SnCl2溶液,混匀,室温放置10 min,使砷元素全部转化为H3AsO3。
②往A瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管B,并使B管右侧末端插入比色管C中银盐吸收液的液面下,控制反应温度25~40℃,45 min后,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③取出C管,向其中添加氯仿至刻度线,混匀,得到砷标准对照液。
(2)乙酸铅棉花的作用是_____________________。
(3)完成生成砷化氢反应的离子方程式:
____Zn+____H3AsO3+____H+=____( )+ ____Zn2++____( )________________
(4)控制A 瓶中反应温度的方法是________________________;反应中,A瓶有较多氢气产生,氢气除了搅拌作用外,还具有的作用是_____________________________。
(5)B管右侧末端导管口径不能过大(约为1mm),原因是__________________________。
【实验3】判断样品中砷含量是否超标
称取ag明矾样品替代【实验2】 ①中“2.00m砷标准溶液”,重复【实验2】后续操作。将实验所得液体与砷标准对照液比对,若所得液体的颜色浅,说明该样品含砷量未超标,反之则超标。
(6)国标规定砷限量为百万分之二(质量分数),则a的值为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com