
【题目】碳和碳的化合物在生产、生活中的应用非常广泛。 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)![]() [Failed to download image : ]CO(g)+H2O(g),得到如下三组数据:
[Failed to download image : ]CO(g)+H2O(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

(1)实验1中,平衡常数K=0.9;v(H2)=0.15mol/(Lmin)该反应的正反应为______(填“吸”或“放”)热反应;
(2)实验3跟实验2相比,改变的条件可能是___________________________
(答一种情况即可);若该反应符合图所示的关系,则在图中Y轴表示___________________________
(3)能判断该反应达到化学平衡状态的依据是______(多选扣分).
a.容器中压强不变 b.混合气体中c(CO )不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O)由此可以判断此时的温度为______.其它条件不变,升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的密度______(填“增大”、“减小”或“不变”).
(5)
【答案】 吸热 使用了催化剂或加大了压强 CO2或H2的百分含量(或其浓度,质量,物质的量) b,c 830 正 不变 33.3%
【解析】(1)从表格数据分析,温度升高,二氧化碳的转化率从原来的1.5/4变为1/2,转化率增大,说明平衡正向移动,则正反应为吸热反应。(2)实验3和实2比,起始加入量相同,温度相同,但是到平衡的时间缩短,说明实验3使用了催化剂或加大了压强;随着温度升高,平衡正向移动,则Y的数值变小,说明Y可以是CO2或H2的百分含量(或其浓度、质量、物质的量等)。(3)a、容器中的压强始终不变,a错误;b、混合气体中一氧化碳的浓度不变,可以说明达到平衡,b正确;c、正逆反应速率相等,说明达到平衡,c正确;d、一氧化碳的浓度和二氧化碳的浓度相等不能说明反应达到平衡,d错误。故选bc。(4)根据平衡常数的表达式分析,此时平衡常数为1,结合表中的数据分析,该温度为830℃。升温,平衡正向移动,但混合气体的总质量不变,总体积不变,所以密度不变。(5)根据方程式可知
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol) 0 0 0.4 0.2
改变量(mol) x x x x
平衡量(mol) x x 0.4-x 0.2-x
则有(0.4-x)(0.2-x)/x×x=1,解得x=0.8/6,则一氧化碳的转化率=![]() ×100%=33.3%。
×100%=33.3%。


科目:高中化学 来源: 题型:
【题目】—定温度下,将2molSO2和lmolO2充入10L恒容密闭容器中,发生反应 2SO2(g) +O2(g) ![]() 2SO3(g) △H=-196 kJmol-1,5min时达到平衡,测得反应放热166.6 kJ。下列说法错误的是
2SO3(g) △H=-196 kJmol-1,5min时达到平衡,测得反应放热166.6 kJ。下列说法错误的是
A. 05 min内,用O2表示的平均反应速率v(O2)=0.017 molL-1 min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,起始向容器中充入4 mol SO2和 2 mol O2,平衡时放热小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.ClO2是氧化产物
B.KClO3在反应中得到电子
C.H2C2O4在反应中被还原
D.1 mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
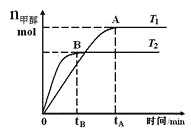
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是_________________,一定存在的阳离子是__________________________。
(2)写出实验③图像中沉淀开始减少至完全消失阶段发生反应的离子反应方程式:__________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______________________,所得沉淀的最大质量是_____________________g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L1,试判断原废水中NO3是否存在?_______(填“存在”“不存在”或“不确定”)。 若存在,c(NO3)=___________mol·L1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制取干燥的氨气:
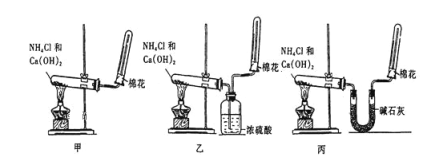
(1)实验室制备氨气化学方程式是_______________________________。
(2)工业制备氨气的化学方程式是_____________________________________________。
(3)若想制得干燥的氨气,应选择装置_______(填“甲”“乙”或“丙”),不能用乙装置干燥氨气的原因_______________________________(用化学方程式表示)。
(4)检验试管C中氨气收集满的方法是______________________。
(5)试管口放置棉花的作用是_________________________________________。
(6)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
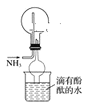
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料。某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。回答下列有关问题。
(背景素材)Ⅰ.NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2;
II.亚硝酸具有一定的氧化性和还原性,酸性条件下:Ca(NO2)2能将I-氧化为I2;
Ⅲ.I2+2S2O32—=2I-+S4O62—
(制备Ca(NO2)2)该小组设计的制备装置如图所示(夹持装置略去)。
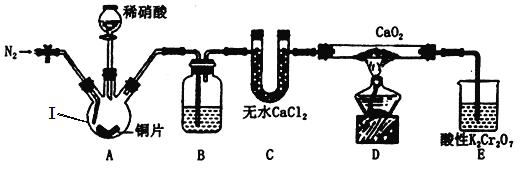
(1)仪器Ⅰ的名称是___________________;B中盛装的试剂是____________________。
(2)制备过程有关操作如下,正确顺序为_______、c、_______、_______、_______、_______。
a.向装置中通入N2 b.向仪器Ⅰ中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入N2 f.关闭分液漏斗旋塞
(3)装置E中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3—,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为__________________________。
(4)整个过程持续通N2的作用是______________、_____________、____________。
(测定Ca(NO2)2的纯度)该小组测定产品中Ca(NO2)2纯度的方法如下:a.称取mg产品、溶解、定容至250mL;b.移取25.00mL溶液于锥形瓶中,加入过量的V1 mLc1mol/L的KI溶液并酸化;c.以淀粉为指示剂,用c2mol/L的Na2S2O3溶液滴定。进行三次平行实验,消耗标准液体积平均值为V2 mL。
(5)测定过程所需仪器在使用前必须检查是否漏液的有______________________。
(6)该产品中Ca(NO2)2的质量分数为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com