
【题目】目前世界上60%的镁单质是从海水中提取的,已知海水提镁的主要步骤如图:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可选用_______。试剂②可选用_______。
(2)本生产流程主要牵涉三个化学反应:写出前两个式子
A.海水→沉淀:__________________(离子方程式)
B.沉淀→溶液:__________________(离子方程式)
C.MgCl2→Mg:
(3)海水中提镁中如何实现对镁离子的富集_______(填代号).
A.直接往海水中加入沉淀剂
B.高温加热蒸发海水后,再加入沉淀剂
C.利用晒盐后的苦卤水,再加入沉淀剂
科目:高中化学 来源: 题型:
【题目】钙是人体必需的元素,缺钙会造成骨骼和牙齿脆弱。当从食物中不足以得到人体所需的钙时,就要用含钙的药品来“补钙”。下列物质中,可以作为补钙药品的是
A.CaCO3 B.CaO C.Ca(OH)2 D.Ca
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
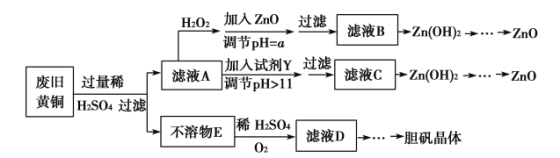
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是______________________,a的范围________________________。
(2)由不溶物E生成溶液D的化学方程式为____________________________。
(3)滤液A中加入H2O2反应的离子方程式为________________________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是__________________________
(5)下列试剂可作为Y试剂的是____________。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能减慢化学反应速率的是
A.将煤块粉碎后燃烧
B.将食物贮藏在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中:NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
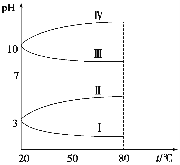
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= 。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
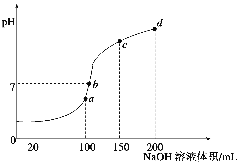
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.铝与稀硫酸反应:Al+2H+= Al 3++H2↑
B.碳酸钙与稀盐酸的反应:CO32-+2H+=CO2+H2O
C.氢氧化铁与盐酸的反应:H++OH-=H2O
D.三氯化铁腐蚀印刷线路板:2Fe3++Cu=2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素的第一电离能:N________O(填“>”或“<”)。
(2)基态Fe2+的电子排布式为___________________________。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
In/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 575 | … |
则该元素的元素符号是________。
(4)NO![]() 的空间构型_____________________(用文字描述),SO
的空间构型_____________________(用文字描述),SO![]() 中硫原子的杂化方式为________________________。
中硫原子的杂化方式为________________________。
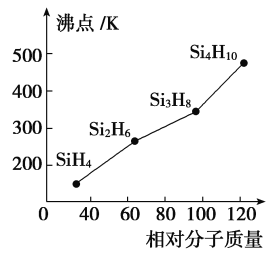
(5)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是_______________________。
(6)金属铜原子的堆积方式为面心立方最密堆积,铜的原子半径为r nm,则铜晶胞的体积表达式为________ cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com