
【题目】已知:①铅蓄电池总反应为: Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列关于电池的叙述正确的是
A.充电电池的化学反应原理是氧化还原反应
B.铅蓄电池可以无限制地反复放电、充电,不会造成环境污染
C.铅蓄电池比锂电池的理论比能量高
D.铅蓄电池正极电极反应为:PbO2 +4H+ +2e— = Pb2+ +2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:2A(g)+ B(g)=2C(g),若经2s后测得C的浓度为1.2mol/L,下列说法符合题意是( )
A. 用物质A表示的反应速率为1.2 mol/(Ls)
B. 用物质B表示的反应速率为0.3mol/(Ls)
C. 2s时物质A的转化率为40%
D. 2s时物质B的浓度为0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为298K、308K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和___探究温度对该反应速率的影响; (Ⅲ)实验①和___探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=___(忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s......)为___,可能原因是___。
③反应速率最小的时间段为___,可能原因是___。
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H2气体总量的情况下,你认为他上述做法中可行的是___(填相应字母);
A.蒸馏水 B.NaNO3溶液 C.NaCl溶液 D.CuSO4溶液 E.Na2CO3
(4)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如图甲、乙所示的实验。请回答相关问题:
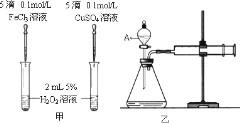
①定性如图甲可通过观察___,定性比较得出结论。甲同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。受甲同学的启发乙同学提出了另一种方案,你猜想乙同学的方案是___;
②定量如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
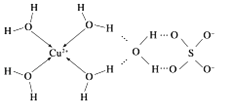
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.
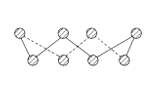
(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是______(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
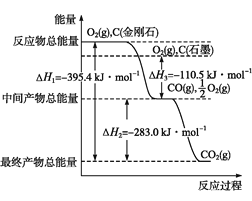
由上图可知,在通常状况下,金刚石和石墨中___(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__kJ·mol1
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol1、497 kJ·mol1,N2(g)+O2(g)=2NO(g) ΔH=180.0 kJ·mol1。NO分子中化学键的键能为_____kJ·mol1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥少量MgSO4固体
A. ①②③⑤B. ③C. ③④⑥D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热容积不变的密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
A.容器内气体的总质量保持不变
B.断裂lmolN≡N键的同时断裂3molH-H键
C.容器中H2的浓度保持不变
D.v(N2):v(H2):v(NH3)=1:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com