
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
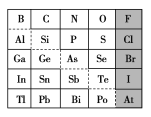
(1)元素Ga在元素周期表中的位置为:第________周期第________族。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物为________。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是________元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4________(填“>”“<”或“=”)H2SeO4。
③氢化物的还原性:H2O________(填“>”“<”或“=”)H2S。
④原子半径比较:N________(填“>”“<”或“=”)Si。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱__________________________
(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液.)
【答案】4 ⅢA +4 HClO4 Bi2O5 ①F ②< ③< ④< B CaCO3固体,盐酸,饱和NaHCO3溶液, Na2SiO3溶液
【解析】
(1)根据Ga和Al同主族,在Al的下一个周期来回答判断;
(2)根据同主族元素性质递变规律来回答;
(3)同主族元素从上到下,氢化物稳定性减弱,原子半径逐渐增大,最高价含氧酸的酸性减弱,同周期元素从右到左,氢化物稳定性减弱,原子半径逐渐增大,最高价含氧酸的酸性减弱,据此回答;
(4)金属和非金属的分界线附近来寻找半导体材料;
(5)根据元素的最高价含氧酸的酸性越强,则元素的非金属性越强来回答。
(1)Ga和Al同主族,在Al的下一个周期,位于周期表第四周期ⅢA族,故答案为:4;ⅢA;
(2)Sn和碳同主族,最高价是+4价;Cl的最高价是+7价,最高价氧化物对应水化物的化学式为HClO4;Bi和N元素同主族,所以最高正价是+5价,最高价氧化物为Bi2O5,故答案为:+4;HClO4;Bi2O5;
(3)①同主族元素从上到下,氢化物稳定性减弱,同周期元素从右到左,氢化物稳定性减弱,所以阴影部分元素氢化物热稳定性最高的是F,故答案为:F;
②As元素和Se元素位于同一周期,同周期元素从右到左,最高价含氧酸的酸性减弱,所以H3AsO4、H2SeO4的酸性强弱:H3AsO4<H2SeO4,故答案为:<;
③O元素和S元素位于同一主族,同主族元素从上到下,非金属性依次减弱,氢化物的稳定性依次减弱、还原性依次增强,则氢化物的还原性:H2O<H2S,故答案为:<;
④N和C位于同一周期,同周期元素从左到右,原子半径依次减小,原子半径N<C,C和Si位于同主族,同主族元素从上到下,原子半径依次增大C <Si,所以原子半径:N<Si,故答案为:<;
(4)可在金属和非金属的分界线附近来寻找半导体材料,故答案为:B;
(5)C、Si的非金属性强弱顺序为C>Si,可以根据碳酸酸性强于硅酸来证明,化学反应中,强酸可以制得弱酸,即在试管中加入CaCO3固体,再加入盐酸,将生成气体通过NaHCO3溶液洗气后,通入Na2SiO3溶液;生成白色胶状沉淀,则碳酸酸性强于硅酸,故答案为:CaCO3固体,盐酸,饱和NaHCO3溶液, Na2SiO3溶液。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。

(4)废水中含氮化合物的处理方法有多种。
① NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液______________L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是______________kJ。
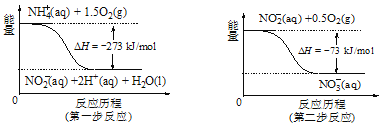
③ 用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH______(填“升高”、“降低”或“不变”)。
(5)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。 [常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是

A. 分子中含有三种含氧官能团
B. 1mol该化合物最多能与4molNaOH反应
C. 既可以发生取代反应,又能够发生加成反应
D. 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( )

A. 用CCl4代替水,测得氢气的体积更准确
B. 量气管压入漏斗的水过多而溢出,会导致测定失败
C. 必须待体系温度降低到0℃时才可进行读数
D. 上提水准管,量气管液面高度不断改变,说明装置漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
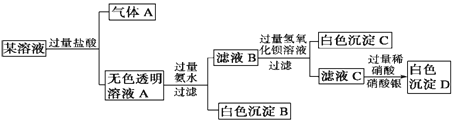
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验题)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)
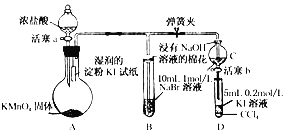
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是____________________
(2)验证氯气的氧化性强于碘的实验现象是____________________
(3)B中溶液发生反应的离子方程式是____________________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________
(5)过程Ⅲ实验的目的是____________________
(6)氯溴碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能力逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 漂白粉的有效成分是次氯酸钙
B. 实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
C. 钠、铁和铜一样都能在氯气中燃烧生成金属氯化物
D. 干燥的氯气可以使有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示。

请回答下列问题:
(1)焰色反应是_____(填“物理”或“化学”)变化;实验③中产生的无色无味气体是_____(填化学式)。
(2)原溶液中一定存在的离子有______________,可能存在的离子有_____________________,一定不存在的离子有______________(写化学式)。
(3)若溶液中K+物质的量为0.04 mol,则c(Na+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com