A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式
;乙为由B元素组成的单质,写出该单质的一种用途
作保护气
作保护气
.
(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
Fe3O4+8H+═2Fe3++Fe2++4H2O
Fe3O4+8H+═2Fe3++Fe2++4H2O
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO
3溶液生成白色沉淀,该反应的化学方程式为
NH4NO2+AgNO3═AgNO2↓+NH4NO3
NH4NO2+AgNO3═AgNO2↓+NH4NO3
,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为
C(NO2->C(NH4+)>C(H+)>C(OH-)
C(NO2->C(NH4+)>C(H+)>C(OH-)
(4)写出C和D形成的化合物与EC
2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:
.
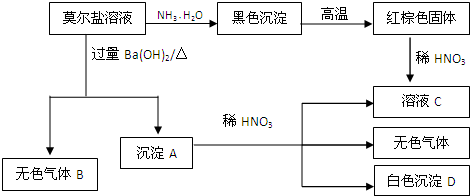
(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
.为探究该复盐中的某种离子,取少量该复盐于试管中并加水溶解,滴加铁氰化钾溶液(K
3[Fe(CN)
6]),则现象和结论为
出现蓝色沉淀,证明有Fe2+
出现蓝色沉淀,证明有Fe2+
.

![]()
![]()
![]()
![]()
 阅读快车系列答案
阅读快车系列答案