
分析 (1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)融化状态下是否能够导电,导电为离子化合物,否则为共价化合物;
(3)①Be与Al的性质相似,则Be与NaOH溶液反应生成Be+2NaOH═Na2BeO2+H2↑;
②Be和Al位于对角线位置,性质相似,Be(OH)2与NaOH反应,而Mg(OH)2不能,则鉴别二者的试剂为NaOH溶液;
(4)元素周期表中某一元素具有如下性质:④其最高价氧化物对应的水化物既可以和酸反应,也可以和碱反应,1mol这种最高价氧化物对应的水化物最多消耗4mol/L 的盐酸1L,该元素处于IVA族,①该元素单质常被用作半导体材料,②其单质与稀盐酸不反应,与氢氧化钠溶液反应可以放出氢气,③其最高价氧化物既可以溶于浓盐酸,也可以溶于氢氧化钠溶液,处于金属与非金属交界处,故为Ge元素.
解答 解:(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故Cs>Na>Mg或Cs>Ba>Mg,故答案为:Na或Ba;
(2)融化状态下是否能够导电,导电为离子化合物,否则为共价化合物,
故答案为:融化状态下是否能够导电,导电为离子化合物,否则为共价化合物;
(3)①Be与Al的性质相似,则Be与NaOH溶液反应生成Be+2NaOH═Na2BeO2+H2↑,反应离子方程式为:Be+2OH-═BeO22-+H2↑,
故答案为:Be+2OH-═BeO22-+H2↑;
②Be(OH)2与NaOH反应,而Mg(OH)2不能,则鉴别二者的试剂为NaOH溶液,故答案为:NaOH溶液;
(4)元素周期表中某一元素具有如下性质:④其最高价氧化物对应的水化物既可以和酸反应,也可以和碱反应,1mol这种最高价氧化物对应的水化物最多消耗4mol/L 的盐酸1L,该元素处于IVA族,①该元素单质常被用作半导体材料,②其单质与稀盐酸不反应,与氢氧化钠溶液反应可以放出氢气,③其最高价氧化物既可以溶于浓盐酸,也可以溶于氢氧化钠溶液,处于金属与非金属交界处,处于第4周期第ⅣA族,为Ge元素,
故答案为:第4周期第ⅣA族.
点评 本题考查元素周期律的应用,侧重考查学生知识迁移应用与类比推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
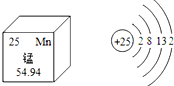 锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )
锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )| A. | 锰原子核内有25个质子,一个锰原子的质量是54.94g | |
| B. | 锰原子核外有4个电子层,其化学性质由最内层电子决定 | |
| C. | MnO2属于氧化物,在H2O2分解制O2的实验中做催化剂 | |
| D. | KMnO4为紫黑色固体,易溶于水、汽油等溶剂,形成紫红色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.
某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
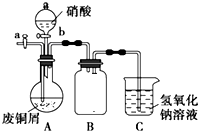 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如图:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )其中既能使KMnO4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
)其中既能使KMnO4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com