
| A. | ①②④ | B. | ③⑥ | C. | ②④ | D. | ①③⑤⑥ |
分析 ①无色溶液中不存在有色的高锰酸根离子;
②pH=11的溶液,显碱性,四种离子之间不反应,都不与氢氧根离子反应;
③加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,碳酸氢根离子能够与氢离子和氢氧根离子反应;
④由水电离出的c(OH-)=10-4mol•L-1的溶液促进了水的电离,溶液中含有弱酸根或弱碱根离子;
⑤铁离子与硫氰根离子反应生成硫氰化铁;
⑥硝酸根离子在酸性条件下能够氧化亚铁离子、碘离子.
解答 解:①无色溶液中不存在有色的MnO4-,故①错误;
②pH=11的溶液,显碱性,CO32-、Na+、[Al(OH)]4-、NO3-离子之间不反应,都不与氢氧根离子反应,可大量共存,故②正确;
③加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,HCO3-能够与酸和碱溶液反应,在溶液中一定不能大量共存,故③错误;
④由水电离出的c(OH-)=10-4mol•L-1的溶液促进了水的电离,含有弱酸根或弱碱根离子,NH4+、Al3+、Cl-、Br-之间不反应,NH4+或Al3+水解,促进了水的电离,满足条件,故④正确;
⑤Fe3+、SCN-反应生成络合物硫氰化铁,不能大量共存,故⑤错误;
⑥酸性溶液中NO3-能够氧化Fe2+、I-,不能大量共存,故⑥错误;
故选C.
点评 本题考查离子的共存,为高频考点,题目难度中等,明确习题中的信息及常见离子之间的反应为解答的关键,注意掌握离子反应发生条件,试题侧重复分解反应、氧化还原反应的离子共存考查.


科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、CO32- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | Na+、K+、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯与浓硝酸、浓硫酸的混合物在100℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾溶液即可检验CH2═CH-CHO中的碳碳双键 | |
| C. | 将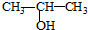 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | NO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | NO2 | NH3 | MgCl2 |
| ④ | NO2 | O2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A. | ①②③ | B. | ①④⑤ | C. | ①②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 充电时储氢合金作阳极 | |
| B. | 充电时阳极周围pH增大 | |
| C. | 放电时负极反应:LaNi5H6+6OH--6e-═LaNi5+6H2O | |
| D. | 放电时每转移6mol电子,有6moLNiO(OH)被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
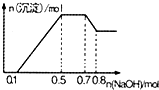 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 无法确定溶液中是否含有CO32-、SO42-和Cl- | |
| C. | 溶液中n(NH4+)=0.2mol | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若M(甲)>M(乙),则分子数:甲>乙 | B. | 若M(甲)<M(乙),则气体摩尔体积:甲>乙 | ||
| C. | 若M(甲)<M(乙),则气体的压强:甲>乙 | D. | 若M(甲)>M(乙),则气体体积:甲<乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com