
下列有关试剂的保存方法,错误的是
A.漂白粉密封保存于阴凉干燥的地方 B.少量的金属钠保存在煤油中
C.盛装NaOH溶液的试剂瓶用橡皮塞 D.新制的氯水保存在无色试剂瓶中
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H+、NO3—、Fe2+、Na+ B.Ag+、NO3—、C1—、K+
C.K+、Ba2+、OH—、SO42— D.Cu2+、NH4+、Br—、OH—
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:选择题
下列说法正确的是
A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B.已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4
C.常温下,将pH =8的醋酸钠溶液稀释,溶液中所有离子浓度都减小
D.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:选择题
下列根据实验事实得出的结论正确的是
| 实 验 事 实 | 结 论 |
A | 加热的铝箔熔化,但液态的铝不滴落 | 熔点:氧化铝>铝 |
B | 溶液中加入盐酸酸化的BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
C | 碳酸钠溶液能使酚酞试液变红 | 碳酸钠溶液呈碱性 |
D | 常温下,铜与冷的浓H2SO4不反应 | 铜与浓硫酸发生钝化 |
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:选择题
下列过程中没有发生氧化还原反应的是
A.天然气燃烧提供热量
B.氯水使红色纸张褪色
C.钢铁制品在空气中被腐蚀
D.二氧化硫通人品红溶液中,溶液褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省泰州市姜堰区高二下学期期中考试 化学试卷(解析版) 题型:实验题
(12分)某化学兴趣小组用如下图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
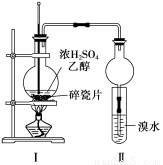

图1 图2
(1)写出该实验中生成乙烯的化学方程式 。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 。
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一现象后并借用pH试纸测定,证明反应中有乙烯生成,请简述
。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2,则A中的试剂是 ,B中的试剂为 。
(5)处理上述实验后烧瓶中废液的正确方法是 。
a.冷却后倒入下水道中 b.冷却后倒入空废液缸中 c.冷却后加水稀释,倒入废液缸中,加废碱中和
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省泰州市姜堰区高二下学期期中考试 化学试卷(解析版) 题型:选择题
实验室可提供下列实验操作:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。如要鉴定1-氯丙烷中的氯元素,从中选择合适的操作步骤是
A.③⑤⑦① B.②③⑦① C.②⑤⑦① D.④②⑥①
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
已知在酸性条件下能发生下列反应:Cu+→ Cu+Cu2+(未配平)。NH4CuSO3与足量的2mol·L-1硫酸溶液混合微热,产生下列现象:①有紫红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
A.该反应显示硫酸具有酸性 B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是二氧化硫 D.反应中硫酸作氧化剂
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:填空题
(10分)在研究原子核外电子排布与元素周期表的关系时,人们发现外围电子排布相似的元素集中在一起。据此,人们将元素周期表重新分为五个区。在1-36号元素中
(1)在s区中,族序数最大的元素,其原子的价电子的电子云形状为 。
(2)在d区中,人类使用最早,应用最广泛的元素的常见离子的电子排布式为 , 。
(3)在ds区中,原子序数最大的元素,原子的价电子排布式为 。
(4)在p区中,第2周期、ⅤA族元素原子价电子的轨道表示式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com