
| A. | 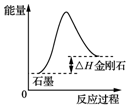 由图可知,从能量角度考虑,金刚石比石墨稳定 | |
| B. | 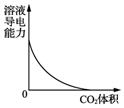 图表示CO2通入饱和Na2CO3溶液中,溶液导电能力的变化 | |
| C. | 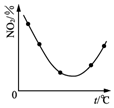 图表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 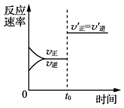 图表示某可逆反应的反应速率随时间的变化,t0时刻改变的条件一定是使用了催化剂 |
分析 A.物质的能量越低越稳定,从图上可知,石墨能量比金刚石低;
B.电解质溶液导电能力强弱取决于离子浓度的大小,将CO2通入饱和Na2CO3溶液中生成NaHCO3,
C.升高温度,化学平衡向吸热的反应方向移动,图示平衡后,N02的含量增大;
D.平衡是不移动的,可能是压强或催化剂的影响.
解答 解:A.从图上可知,石墨能量比金刚石低,石墨稳定,故A错误;
B.将CO2通入饱和Na2CO3溶液中生成NaHCO3,方程式为Na2CO3+CO2+H2O=2NaHCO3↓,碳酸氢钠未答饱和前,碳酸氢钠为强电解质,完全电离,电离方程式为:NaHCO3=Na++HCO3-,碳酸氢根离子在溶液中存在电离平衡和水解平衡:HCO3-?CO32-+H+、HCO3-+H2O?H2CO3+OH-,溶液中离子浓度增大,导电能力增强,当达到饱和时,形成碳酸氢钠沉淀,导电能力减弱,故B错误;
C.由图可知,反应平衡后,升高温度N02的含量增大,平衡逆移,正方向为放热反应,所以该反应的△H<0,故C正确;
D.反应前后气体的体积相等的反应,如:3A (g)?2C(g)+B(g),增大压强或减小压强,平衡不移动,所以图示可能为增大压强,催化剂能改变反应速率,也可能为使用了催化剂,故D错误;
故选C.
点评 本题考查了反应热、化学平衡图象、阅读题目获取信息的能力等,题目难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
| 编号 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
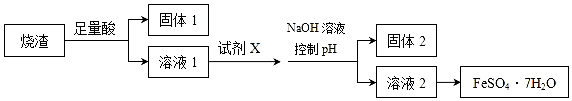
| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
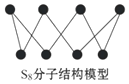
| A. | S2、S4、S6、S8互为同位素 | |
| B. | S2的摩尔质量为32 g/mol | |
| C. | 硫的单质在足量的空气中完全燃烧可生成SO3 | |
| D. | 1 mol S8单质中含有的S-S键个数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18 g CD4中含有NA个碳原子 | |
| B. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| C. | 4.4g乙醛和丁酸的混合物完全燃烧,消耗氧分子的数目为0.25NA | |
| D. | 100mL浓度为lmol/L的蔗糖溶液中所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com