
| A. | NaH+H2O═NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2F2+2H2O═4HF+O2 |
科目:高中化学 来源: 题型:多选题
| A. | CH4(g)+2O2(g)→CO2(g)+2H2O(g)+Q1 CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)+Q2 | |
| B. | S(s)+O2(g)→SO2(g)+Q1 S(g)+O2(g)→SO2(g)+Q2 | |
| C. | H2(g)+Br2(g)→2HBr(q)+Q1 H2(g)+Cl2(g)→2HCl(q)+Q2 | |
| D. | HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)+Q1 CH3COOH(aq)+NaOH(aq)→CH3COONa(aq)+H2O(l)+Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应放出大量的热,甲烷可用作气体燃料 | |
| B. | 如温度超过100℃,反应前后气体的体积不变 | |
| C. | 可用干燥的冷烧杯检验生成的产物为CO2和H2O | |
| D. | 此式中使用箭头表示此反应主产物为CO2和H2O,还可能有其他副产物如CO、C等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
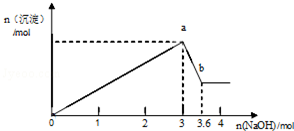 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
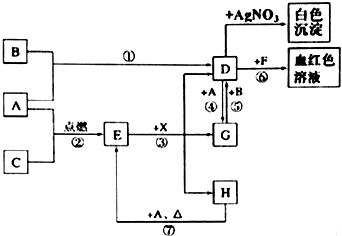
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
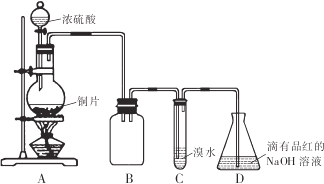
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 异常情况 | 可能原因分析 |
| A | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 蒸馏:温度计读数达到了馏分的沸点且历时10分钟,锥形瓶中却无液体 | 温度计位置错误,或装置漏气,或冷凝水方向反了 |
| D | 检验Fe2+:加入KSCN溶液,溶液呈红色 | Fe2+已部分被氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g甲基所含有的电子数是NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 17g羟基所含有的电子数是10NA | |
| D. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
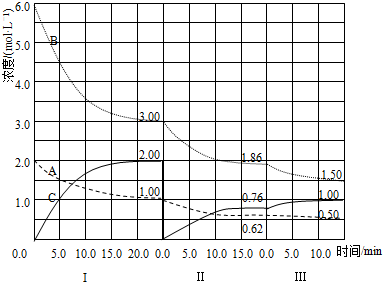
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com