
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4·H2O(三盐),主要制备流程如下。

请回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为_____________。
2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为_____________。
(2)将滤液Ⅰ、滤液Ⅲ合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为______________________。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO。滤液Ⅱ中溶质的主要成分为______(填化学式)。
(4)步骤⑥合成三盐的化学方程式为______________________。
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是__________________。
【答案】16 gNaSO4·10H2OHNO34PbSO4+6NaOH![]() 3PbO·PbSO4·H2O↓+3Na2SO4+2H2O 取少量最后一次洗涤后的滤液于试管中,滴加BaCl2溶液和盐酸,若产生白色沉淀,则沉淀未洗涤完全,若没有白色沉淀生成,则沉淀已洗涤完全
3PbO·PbSO4·H2O↓+3Na2SO4+2H2O 取少量最后一次洗涤后的滤液于试管中,滴加BaCl2溶液和盐酸,若产生白色沉淀,则沉淀未洗涤完全,若没有白色沉淀生成,则沉淀已洗涤完全
【解析】
向铅泥中加入碳酸钠溶液, PbSO4转化为难溶PbCO3的离子方程式为CO32-+ PbSO4= PbCO3+SO42-,然后过滤得到滤液Ⅰ为硫酸钠溶液,向滤渣中加入硝酸酸溶,PbO、Pb、PbCO3都与硝酸反应生成Pb(NO3)2,Pb与硝酸反应还生成NO,铅与硝酸生成Pb(NO3)2及NO的离子方程式为3Pb+8H++2NO3-=Pb2++2NO↑+4H2O,然后向溶液中加入硫酸,生成PbSO4沉淀,过滤,滤液Ⅱ的主要成分是HNO3,向滤渣中加入NaOH溶液,发生反应:4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O↓+3Na2SO4+2H2O,过滤洗涤干燥得到3PbO·PbSO4·H2O,滤液Ⅲ中含有NaSO4,以此解答该题。
3PbO·PbSO4·H2O↓+3Na2SO4+2H2O,过滤洗涤干燥得到3PbO·PbSO4·H2O,滤液Ⅲ中含有NaSO4,以此解答该题。
(1)铅蓄电池在充电时,阳极发生氧化反应, PbSO4被氧化生成PbO2,电极反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42-,若铅蓄电池放电前正、负极质量相等,放电时正极发生:PbO2+2e-+SO42-+4H+=PbSO4+2H2O,负极发生Pb-2e-+SO42-=PbSO4,转移了lmol电子,则正极、负极都生成0.5mol PbSO4, 正极质量增加:m(PbSO4)-m(PbO2)=0.5×(303-207)=32g;负极质量增加m(PbSO4)-m(Pb)= 0.5×(303-207)=48g,则两极质量差为48-32=16g;因此,本题正确答案是:16 g。
(2) 通过以上分析知,滤液Ⅰ和滤液Ⅲ经脱色、蒸发、结晶可得到的副产品为NaSO4·10H2O,其相对分子质量为322;因此,本题正确答案是: NaSO4·10H2O。
(3) 通过以上分析知,该离子反应方程式为3Pb+8H++2NO3-=Pb2++2NO↑+4H2O,滤液2中主要成分是未反应的HNO3;因此,本题正确答案是: HNO3。
(4)硫酸铅与氢氧化钠在加热到50-60℃情况下反应生成3PbO·PbSO4·H2O和Na2SO4;步骤⑥合成三盐的化学方程式为4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O↓+3Na2SO4+2H2O;因此本题答案是:4PbSO4+6NaOH
3PbO·PbSO4·H2O↓+3Na2SO4+2H2O;因此本题答案是:4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O↓+3Na2SO4+2H2O。
3PbO·PbSO4·H2O↓+3Na2SO4+2H2O。
(5) 该沉淀吸附的离子是硫酸根离子,用盐酸和氯化钡溶液进行检验,其检验方法为取少量最后一次洗涤后的滤液于试管中,向其中滴加BaCl2溶液和盐酸,若不产生白色沉淀,则表明已洗涤完全;因此,本题正确答案是: 取少量最后一次洗涤后的滤液于试管中,滴加BaCl2溶液和盐酸,若产生白色沉淀,则沉淀未洗涤完全,若没有白色沉淀生成,则沉淀已洗涤完全。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在工业上,铝常用于冶炼难熔金属,这一用途主要是由于铝( )
A.具有强还原性,反应中放出大量的热
B.高温时在空气中能燃烧
C.具有良好导热性
D.反应后生成熔点更高的氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:
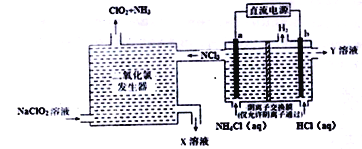
下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒取少量无水CuSO4与熔化的钠相接触瞬间产生耀眼的火花,同时有红色物质生成。据此判下列说法中不正确的是
A. 上述反应是置换反应
B. 上述反应是放热反应
C. 上述反应中无水CuSO4表现了还原性
D. 加热且无水条件下,钠可以与CuSO4反应并生成Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)表中能形成两性氢氧化物的元素是(填元素符号)______,最不活泼的元素的原子结构示意图为________。
(2)③号元素和⑧号元素的气态氢化物中,热稳定性较强的是(填化学式)________
(3)④号元素和⑥号元素的离子半径较大的是(填离子符号)_______
(4)上述元素中,金属性最强的元素与非金属最强的元素形成化合物的化学式______
(5)②的氢化物发生催化氧化的化学方程式为___________。
(6)写出⑤号元素的最高价氧化物对应的水化物和⑧号元素的最高价氧化物对应的水化物发生反应的离子方程式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合反应后,最终有白色沉淀生成的是
A. 金属钠投入到FeCl3溶液中 B. 明矾溶液和过量NaOH溶液混合
C. 向Na2SiO3溶液中通入足量CO2 D. 氯化钙溶液中通入少量的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2的某些性质的装置,试回答

试回答:
(1)②中的实验现象为______________。
(2)④中的实验现象为______________,此实验说明SO2有____________性.
(3)⑤中的实验现象为____________,此实验说明SO2有________性.
(4)⑥的作用是___________,反应方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式________________________________。
(2)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,试判断溶于水后,形成的合理结构是________。(填图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________。(填图中的字母)

(3)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl,CoCl3·5NH3中Co化合价为__________,请写出表示此配合物结构的化学式:______________。
(4)H2O、H2S、H2Se熔沸点由低到高的顺序:_________________。
(5)HF比HCl热稳定性____(填“强”或“弱”),原因是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )

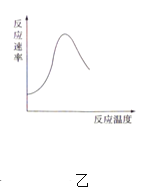


A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示除去氧化膜的镁条投入到稀盐酸中,反应速率v随时间t的变化曲线
D. 图丁表示某温度下V1mLl.0 mol/L HC1溶液和V2 mL1.5mol/L的NaOH溶液混合均匀后溶液温度随V1的变化趋势(V1+V2=50mL)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com