
18 8 |
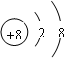
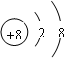
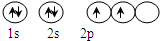



18 8 |
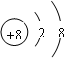 ,故答案为:8;8;10;
,故答案为:8;8;10;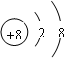 ;
; ;
; ,
, ;
; .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
A. 168O2和 188O2互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、NO3- 、HCO3- 、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D. C(石墨, s) =C(金刚石, s);ΔH>0,所以石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 188 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com