
| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
分析 从大量母体物质中搜集欲测定的痕量元素至一较小体积,从而提高其含量至测定下限以上的这一操作步骤为富集,根据该操作过程是否符合富集概念判断.
解答 解:A.金沙中Au含量很小,通过水洗法得到金属Au单质,从而达到富集的目的,故A不选;
B.沙子中含有大量Si元素,再通过化学方法得到Si单质,沙子中Si含量很大,所以该过程不属于富集,故B选;
C.海水中Br元素含量很少,通过化学方法得到溴单质,从而达到富集的目的,故C不选;
D.浓缩海水中镁离子含量很小,通过一系列的化学反应后得到镁单质,从而达到富集镁的目的,故D不选;
故选B.
点评 本题考查了海水资源的综合利用,明确富集概念内涵是解本题关键,根据富集概念来分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ,则该有机物核磁共振氢谱有3 个峰.
,则该有机物核磁共振氢谱有3 个峰.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | NaOH溶液 | C. | Ba(OH)2溶液 | D. | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
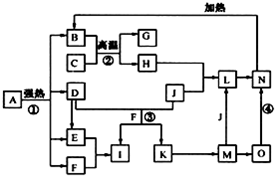 仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去).请按要求回答:
仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去).请按要求回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
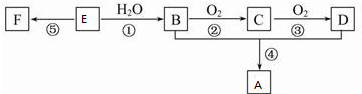
 ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
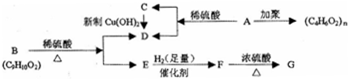
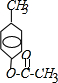 ;
;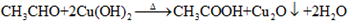 ,反应类型氧化反应;F→G
,反应类型氧化反应;F→G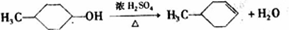 ,反应类型消去反应.
,反应类型消去反应.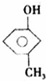 、
、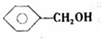 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)(5) | B. | (1)(3)(4) | C. | (1)(2)(4)(5) | D. | (1)(2)(3)(4)(5) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com