
| A. | 10mol | B. | 16mol | C. | 20mol | D. | 36mol |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
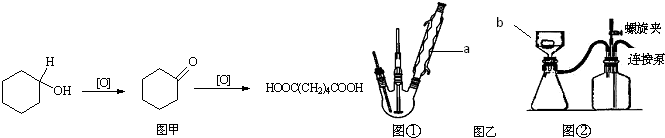
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥③⑤ | B. | ④⑥③⑤ | C. | ④⑥①③ | D. | ②⑥①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A>B>D>C | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 原子结构的最外层电子数目A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,用电子式表示A与B形成的三原子分子的形成过程
,用电子式表示A与B形成的三原子分子的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).
利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com