
分析 (1)反应Ni(S)+4CO(g)?Ni(CO)4(g)+Q是放热反应,反应前后气体体积减小,依据平衡移动原理分析;
(2)由反应①为放热反应可知反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小.
解答 解:(1)反应①是气体体积减少的放热反应,因此在温度不变的情况下,采取增大体系压强、从反应体系中移走Ni(CO)4(g)等措施均可使反应正向进行,提高Ni(CO)4的产率,
故答案为:增大压强;从反应体系中移走Ni(CO)4(g);
(2)由反应①为放热反应可知反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小,
a.温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向进行,平衡常数减小,故a错误;
b.温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向进行一氧化碳浓度减小,故b正确;
c.依据反应分析,温度降低反应①平衡正向进行,反应②逆向进行,镍质量减小,故c正确;
d.平衡逆向进行,温度降低,v逆[Ni(CO)4]减小,故d错误;
故答案为:bc.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确化学平衡及其影响因素为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
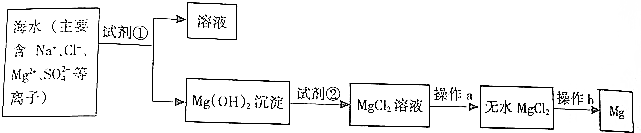
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
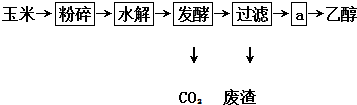
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1mol•L-1 | |
| B. | b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | c点所示溶液中:c(Na+)<3c(R2-) | |
| D. | d点所示溶液中:c(Na+)>c(R2-)>c(HR-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
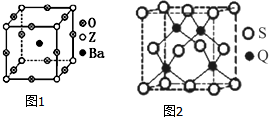 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
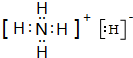 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com