
分析 (1)发生反应:2Na2O2+4H2O═4NaOH+2H2O+O2↑,过氧化钠起氧化剂、还原剂作用,氧化产物为氧气,还原产物为水;
(2)(3)根据n=$\frac{m}{M}$计算过氧化钠的物质的量,根据方程式2Na2O2+2H2O═4NaOH+O2↑计算生成氧气、氢氧化钠的物质的量,再根据V=nVm计算氧气体积,根据m=nM计算NaOH的质量,溶液质量=过氧化钠质量+水的质量-氧气质量,进行计算溶液质量分数.
解答 解:7.8g Na2O2的物质的量=$\frac{7.8g}{78g/mol}$=0.1mol,则:
2Na2O2+2H2O═4NaOH+O2↑
2mol 4mol 1mol
0.1mol n(NaOH) n(O2)
故n(NaOH)=2n(Na2O2)=0.2mol
n(O2)=$\frac{1mol×0.1mol}{2mol}$=0.05mol
(1)发生反应:2Na2O2+4H2O═4NaOH+2H2O+O2↑,过氧化钠起氧化剂、还原剂作用,氧化产物为氧气,还原产物为水,标出电子转移数目与方向为: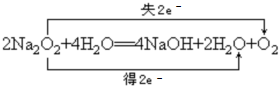 ,
,
故答案为: ;
;
(2)V(O2)=0.05mol×22.4L/mol=1.12L,
答:生成氧气的体积为1.12L;
(3)m(NaOH)=0.2mol×40g/mol=8g,溶液质量=7.8g+193.8g-0.05mol×32g/mol=200g,故溶液质量分数为$\frac{8g}{200g}$×100%=4%,
答:溶液质量分数为4%.
点评 本题考查氧化还原反应电子转移表示、化学方程式计算,(1)中利用单线桥可以避免学生认为氢氧化钠是还原产物的错误,注意对反应原理的理解,难度中等.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ②和③ | C. | 只有① | D. | ①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ④⑥ | C. | ③④⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究Cl2、SO2、CO2、NH3等气体的性质对生产和生活与重要的意义.
研究Cl2、SO2、CO2、NH3等气体的性质对生产和生活与重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al (OH)3+3HCl═AlCl3+3H2O | B. | 3Fe+4H2O(g)=Fe3O4+4H2 | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,固体Mg(OH)2在20ml0.01 mol•L-1氨水中的KSP比20mL0.01 mol•L-1NH4Cl溶液中的KSP小 | |
| B. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的C(Mg)2+大 | |
| C. | 25℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 | |
| D. | 25℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,C(Mg2+)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com