
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
| 0.05mol/L×0.02L×5 |
| 0.01L |


科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)在体积不变的2L密闭容器中,进行如下化学反应:CO2(g)+H2(g) 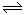 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 500 | 600 | 800 | 900 | 1000 |
K | 0.5 | 0.6 | 1.0 | 1.3 | 1.5 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应正反应为_____反应(选填“吸热”“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:
3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________。
(4)若800 ℃时,向容器中充入2 mol CO2、2 mol H2,反应进行到5min内,容器内CO的体积分数为20%,则用CO2表示的平均反应速率为 ,达到平衡后,CO2的转化率为 。
(5)800 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
已知①2C(s)+O2(g)=2CO(g);ΔH=-221.0kJ/mol ②2H2(g)+O2(g)=2H2O(g);
ΔH =-483.6kJ/mol。则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g);ΔH为
A.+262.6kJ/mo1 B.-131.3kJ/mol
C.-352.3kJ/mol D.+131.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
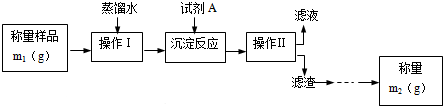
查看答案和解析>>
科目:高中化学 来源: 题型:
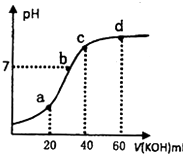 常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmol?L-1的KOH溶液,溶液的pH变化曲线如图所示.下列有关说法正确的是
常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmol?L-1的KOH溶液,溶液的pH变化曲线如图所示.下列有关说法正确的是| A、a点溶液呈酸性,是因为HC204-的电离程度小于其水解程度 |
| B、b点:c(K+)=c(HC2O4-)+2c(C2O42-) |
| C、c点:c(K+)=c(H2C2O4)+c(HC2O4-)+2c(C2O42-) |
| D、d点:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、K+、HCO3-、OH- |
| B、Al3+、NH4+、CO32-、Cl- |
| C、Na+、Ba2+、OH-、NO3- |
| D、H+、NH4+、SO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
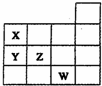 如图表示元素周期表前四周期的一部分,关于元素X,Y,Z,W的叙述正确的是( )
如图表示元素周期表前四周期的一部分,关于元素X,Y,Z,W的叙述正确的是( )| A、只有② | B、①②⑤ |
| C、①②③ | D、①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH2=CH2+HCl
| |||
B、CH3CH2OH+HBr
| |||
C、2CH3CH0+02
| |||
D、CH3CH2Br+NaOH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com