
【题目】艾司洛尔(I)是预防和治疗手术期心动过速的一种药物,某合成路线如图,回答下列问题:

(1)A的化学名称为___,D中所含官能团的名称为____。
(2)G→H的反应类型为___,H→I的反应类型为___。
(3)C→D中步骤①的化学反应方程式为____。
(4)X是F的同分异构体,若同时满足下列条件中的①②④,则X有___种同分异构体;若同时满足下列条件中的①②⑤,则X有____种同分异构体;若同时满足下列条件中的①②③,请写出X的结构简式___。
①与碳酸氢钠溶液反应生成二氧化碳②与FeCl3溶液发生显色反应③核磁共振氢谱有四组峰且峰面积之比为6:2:1:1④苯环上只有两个取代基⑤苯环上只有三个取代基
(5)参照上述合成路线,设计以![]() 和
和 为主要原料制备
为主要原料制备 的合成路线。___
的合成路线。___
【答案】对甲基苯酚 羟基、醛基 取代反应 加成反应  +4NaOH
+4NaOH +2NaCl+CH3COONa+2H2O 6 20
+2NaCl+CH3COONa+2H2O 6 20 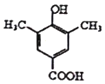 或
或

【解析】
根据A的化学式C7H8O,由C逆推得出A的结构简式为![]() ,B为
,B为 ,根据C→D发生的两步反应推出D为
,根据C→D发生的两步反应推出D为 ,1molD和1mol丙二酸在叱咤、苯胺中反应生成1mol E、1molH2O和1molCO2,且E能与溴水发生加成反应,结合E的分子式,E为
,1molD和1mol丙二酸在叱咤、苯胺中反应生成1mol E、1molH2O和1molCO2,且E能与溴水发生加成反应,结合E的分子式,E为 ,E和氢气发生加成反应生成F为
,E和氢气发生加成反应生成F为 ,F和甲醇发生酯化反应生成G为
,F和甲醇发生酯化反应生成G为 。
。
(1)根据A的化学式C7H8O,由C逆推得出A的结构简式为![]() ,A的化学名称为对甲基苯酚,根据C→D发生的两步反应①
,A的化学名称为对甲基苯酚,根据C→D发生的两步反应① +4NaOH
+4NaOH![]()
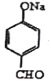 +2NaCl+CH3COONa+2H2O,②在H+条件下,
+2NaCl+CH3COONa+2H2O,②在H+条件下, 转化为D
转化为D ,
, 中所含官能团的名称为羟基、醛基;
中所含官能团的名称为羟基、醛基;
(2)G为 ,G中酚羟基上的氢原子被
,G中酚羟基上的氢原子被![]() 所取代从而得到H,故G→H的反应类型为取代反应,H→I是
所取代从而得到H,故G→H的反应类型为取代反应,H→I是 与(CH3)2CHNH2发生加成反应生成
与(CH3)2CHNH2发生加成反应生成 ,反应类型为加成反应;
,反应类型为加成反应;
(3)C→D中步骤①的化学反应方程式为 +4NaOH
+4NaOH![]()
 +2NaCl+CH3COONa+2H2O;
+2NaCl+CH3COONa+2H2O;
(4)X的分子式为C9H10O3,根据①与碳酸氢钠溶液反应生成二氧化碳,说明含有-COOH;②与FeCl3溶液发生显色反应,说明含有酚羟基;③核磁共振氢谱有四组峰且峰面积之比为6:2:1:1,有四种不同环境的氢原子,④苯环上只有两个取代基⑤苯环上只有三个取代基,若同时满足条件中的①②④,则苯环上除了酚羟基外,另一取代基为-CH2CH2COOH或-CH(CH3)COOH,位置有邻、间、对位,故符合条件的X有6种同分异构体;
若同时满足下列条件中的①②⑤,则苯环上除了酚羟基个,可以有另两个取代基为甲基和-CH2COOH、乙基和-COOH,根据每种组合定一议二,两取代基在邻、间、对位后第三个取代基定上有4+4+2=10种,两种组合,故X有20种同分异构体;
若同时满足下列条件中的①②③,有四种不同环境的氢原子,符合条件的X的结构简式为 或
或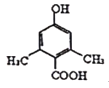 ;
;
(5)以![]() 和
和 为主要原料制备
为主要原料制备 ,对比原料和目标产物的结构简式,
,对比原料和目标产物的结构简式,![]() 中羧基发生酯化反应应引入—COOCH3,碳碳双键发生加成反应,模仿流程中G→H引入醚键,则合成路线为
中羧基发生酯化反应应引入—COOCH3,碳碳双键发生加成反应,模仿流程中G→H引入醚键,则合成路线为 。
。


科目:高中化学 来源: 题型:
【题目】实验室需要用480mL0.1molL-1的硫酸铜溶液,以下配制方法正确的是( )
A. 称取![]() 胆矾(CuSO4·5H2O),配成500mL溶液
胆矾(CuSO4·5H2O),配成500mL溶液
B. 称取![]() 胆矾(CuSO4·5H2O),加入500mL水配成溶液
胆矾(CuSO4·5H2O),加入500mL水配成溶液
C. 称取![]() 无水硫酸铜粉末,加入480mL水配成溶液
无水硫酸铜粉末,加入480mL水配成溶液
D. 称取![]() 无水硫酸铜粉末,加入500mL水配成溶液
无水硫酸铜粉末,加入500mL水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A. 0.1mol·L-1K2CO3溶液中:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B. 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀多于AgBr沉淀
C. 常温下,pH=4.75、浓度均为0.1mol/L 的CH3COOH、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D. 已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mol/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)![]() zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
A.z=4
B.B物质的转化率是20%
C.A的平衡浓度是1.6mol/L
D.平衡时气体压强是原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中互为同分异构体的有____,互为同素异形体的 有________,互为同位素的有________,是同一种物质的有________(填序号)。
(1)液氯 (2)氯气(3)白磷(4)红磷 (5)35Cl (6)37Cl
(7)![]() (8)
(8)![]() (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )

A. 阴极与阳极产生的气体体积比为1:2 B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com