
| A. | 高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32- )=1 mol•L-1,则溶液中Na+的个数为2 NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中c(Na+)=2 mol•L-1 |
分析 A、求出铁的物质的量,然后根据铁与水蒸气反应后变为+$\frac{8}{3}$价来分析;
B、铁粉在浓硫酸中可能会钝化;
C、CO32- 为弱酸根,在溶液中会水解;
D、过氧化钠由1个过氧根离子和2个钠离子构成.
解答 解:A.16.8g铁的物质的量为0.3mol,而铁与水蒸气反应后变为+$\frac{8}{3}$价,故0.3mol铁失去0.8mol电子即0.8NA个,故A正确;
B.常温下,铁和浓硫酸发生钝化现象,阻止了铁进一步和浓硫酸发生氧化还原反应,故B错误;
C.碳酸钠是强碱弱酸盐,碳酸根离子易水解而使其溶液呈碱性,在1L的碳酸钠溶液中,若c(CO32-)=1 mol•L-1,则Na+个数大于2NA,故C错误;
D.过氧化钠中阴阳离子分别是过氧根离子和钠离子,含4NA个离子的固体Na2O2中,过氧化钠的物质的量大于1mol,溶于水配成1L溶液,所得溶液中Na+的浓度大于1mol/L,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变成白色 | 该过程发生物理变化 |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成蓝色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 向硝酸亚铁溶液中滴入稀硫酸 | 无明显现象 | 硝酸亚铁与硫酸不反应 |
| D | 将滴有酚酞的氨水加热 | 红色逐渐变浅 | 一水合氨受热分解,导致溶液碱性减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
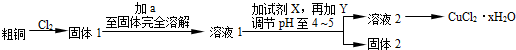
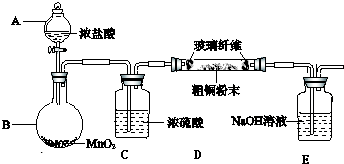
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为8.4g | B. | 物质的量为2 mol | ||
| C. | 体积为4.48 L | D. | 原子数目为0.56NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1mol H2SO4的浓硫酸与足量铜反应转移的电子总数为2NA | |
| B. | 标准状况下,22.4LO2作氧化剂时转移电子数一定为4NA | |
| C. | 10L0.1mol•L-1的Na2CO3溶液中,Na+、CO32-总数为3NA | |
| D. | 通常状况下,4.2g丙烯中所含碳氢键数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO32-、Ba2+ | B. | NH4+、Na+、OH-、Cl- | ||
| C. | Al3+、Mg2+、SO42-、Cl- | D. | Fe2+、NO3-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com