
【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
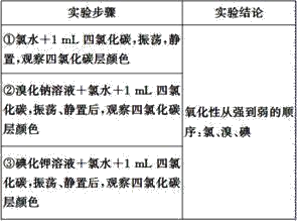
实验药品:溴化钠溶液、碘化钾溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是__、__。
(2)②中反应的化学方程式为__;③中反应的离子方程式为__。
(3)四氯化碳在实验中所起的作用是__。
(4)该同学的实验设计不足之处是__,改进的办法是__。
【答案】试管 胶头滴管 2NaBr+Cl2=2NaCl+Br2 Cl2+2I-=2Cl-+I2 萃取剂 没能比较出溴和碘单质的氧化性强弱 将第③改为碘化钾溶液+溴水+1mL四氯化碳,振荡、静置,观察四氯化碳层的颜色
【解析】
(1)该实验用量筒量取试剂,可在试管中进行反应;
(2)②中反应的化学方程式为 2NaBr+Cl2=2NaCl+Br2;③中反应的离子方程式为2I-+Cl2=2Cl-+I2;
(3)四氯化碳不参加反应,但卤素单质不易溶于水,易溶于四氯化碳;
(4)不能比较溴、碘的氧化性强弱,以此来解答。
由非金属单质间的置换反应来比较单质的氧化性强弱可知,Cl2能置换出Br2、I2,Br2能置换出I2,则说明氧化性Cl2>Br2>I2,
(1)该实验用量筒量取试剂,可在试管中进行反应,还需要胶头滴管滴加液体,
故答案为:试管、胶头滴管;
(2)②中反应的化学方程式为2NaBr+Cl2=2NaCl+Br2;③中反应的离子方程式为2I+Cl2=2Cl+I2,
故答案为:2NaBr+Cl2=2NaCl+Br2;2I+Cl2=2Cl+I2;
(3)四氯化碳不参加反应,但卤素单质不易溶于水,易溶于四氯化碳,所以其作用为萃取剂,使生成的Br2、I2溶于其中,便于观察现象,
故答案为:萃取剂;
(4)设计的实验中不能证明溴的氧化性强于碘,把第③步改为:KI溶液+溴水+1mLCCl4,振荡,静置,观察CCl4层颜色,
故答案为:没有比较Br2和I2的氧化性强弱;把第③步改为:将溴水滴在KI淀粉试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1mLCCl4,振荡,静置,观察四氯化碳层颜色)。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,气态分子断开1mol化学键所需的能量称为键能。已知H-H,H-O,和O=O键的键能分别为436kJ/mol,463kJ/mol,495kJ/mol,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+![]() O2(g)△H=-485kJ/mol
O2(g)△H=-485kJ/mol
B.H2O(g)=H2(g)+![]() O2(g)△H=+485kJ/mol
O2(g)△H=+485kJ/mol
C.2H2(g)+O2(g)=2H2O(g)△H=+485kJ/mol
D.2H2(g)+O2(g)=2H2O(g)△H=-485kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如下:

回答下列问题:
(1)化合物 A 中含氧官能团的名称是______。检验该官能团的化学反应方程式为______。
(2)化学反应①和④的反应类型分别为________和______。
(3)化学物B与等物质的量的Br2加成,最多生成_____种产物(不考虑顺反异构)。
(4)化合物 C 的结构简式为________。
(5)反应⑦的化学方程式为_______。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:______(不考虑立体异构)。
(7)根据该试题提供的相关信息,设计由化合物 ![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物![]() 的合成路线图___。
的合成路线图___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有14 mL由二氧化氮和氧气组成的混合气体的量筒倒立于水槽中,充分反应后剩余4 mL气体(相同状况下测定),原混合气体中二氧化氮和氧气的体积分别是多少?____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
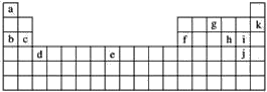
用上表中的字母代号回答下列问题:
(1)属于短周期元素的有__;
(2)属于稀有气体元素的有__;
(3)属于第ⅠA金属元素的有__;
(4)写出c元素在周期表中的位置__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将pH=12的NaOH溶液平均分成两份,一份加水V1 L,另一份加入与该NaOH溶液物质的量浓度相等的硫酸V2 L,pH都降低了1,则V1 :V2 为(溶液体积可以叠加)
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分被氧化的铝箔5.01 g,加入足量的10%的稀盐酸,充分反应后收集到0.5 g氢气。
(1)被氧化的金属铝的质量为多少克?__________________
(2)参加反应的稀盐酸的质量为多少克?____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() N2O2(g)(快) △H1<0 平衡常数 K1
N2O2(g)(快) △H1<0 平衡常数 K1
②N2O2(g)+O2(g) ![]() 2NO2化) (慢) △H2<0 平衡常数K2
2NO2化) (慢) △H2<0 平衡常数K2
下列说法正确的是
A. 2NO(g) +O2(g)![]() 2NO2(g)的△H= -(△H1+△H2)
2NO2(g)的△H= -(△H1+△H2)
B. 2NO(g) +O2(g)![]() 2NO2 (g)的平衡常数 K =
2NO2 (g)的平衡常数 K =![]()
C. 反应②的速率大小决定2NO(g)+O2(g) ![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
D. 反应过程中的能量变化可用下图表示

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com