
【题目】已知元素砷(As)的原子序数为33,下列叙述正确的是( )
A. 砷元素的最高化合价为+3价
B. 砷原子的第三电子层含有8个电子
C. 砷元素是第四周期的主族元素
D. 砷的氧化物的水溶液呈强碱性
科目:高中化学 来源: 题型:
【题目】2016年7月报道,南开大学科研团队在“可充室温钠-二氧化碳电池”的研究中取得突破进展,该电池放电时工作情况如图所示。下列说法错误的是

A. 金属Na为电池的负极
B. 放电时,电解液中Na+向碳电极移动
C. 充电时,碳电极发生的反应为:4Na++4e-+3CO2== 2Na2CO3+C
D. 放电时,每转移2 mol电子,消耗标准状况下的CO2 33.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属的叙述中,不正确的是( )
A.钾元素比钠元素的金属性强B.钾和钠的焰色分别为紫色和黄色
C.钠原子比钾原子易失电子D.碱金属的熔点随着电子层数的增加而降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是宇宙中含量最高的元素,占宇宙总质量的75%,应用前景十分广阔。
(1)氢有1H、2H、3H三种常见的核素,它们互称为____;氢元素的相对原子质量约为1.008,则三种核素中丰度(百分含量)最高的是____。
(2)2H2O可用作核反应堆的减速剂,1个 2H2O分子中所含中子的个数为___。
(3)H可与N形成多种分子,其中某分子含18个e-、6个原子,则该分子的结构式为__。
(4)工业上用C和H2O制取H2。已知:
①C(s) + H2O(g) = H2(g) + CO(g) ΔH1 ②C(s) + 2H2O(g) = 2H2(g) + CO2(g) ΔH2
则CO(s) + H2O(g) = H2(g) + CO2(g) ΔH =__(用ΔH1、ΔH2表示)。
(5)NaBH4是一种重要的储氢载体。
①B在元素周期表中的位置为___。
②NaBH4(s)与H2O (l)反应生成NaBO2(s)和一种气体,在25℃,101kPa下,已知每消耗3.8g NaBH4放热21.6kJ,则该反应的热化学方程式为________;反应前后B的化合价不变,则反应消耗1molNaBH4时转移的电子数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据下列图示,写出反应的热化学方程式。

A.___________________________________。
B.___________________________________。
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式为___________________。
(3)如图是598 K时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_________。
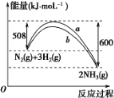
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 碱金属的单质中,锂的还原性最强
B. 第ⅠA族元素比第ⅡA族元素的金属性强
C. 最外层电子数为6的原子都是非金属原子
D. 随着核电荷数的递增,卤素元素的气态氢化物的稳定性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象不属于蛋白质变性的是
A.打针时用酒精消毒
B.用稀的福尔马林浸泡种子
C.蛋白质溶液中加入食盐变浑浊
D.用波尔多液(主要含有CuSO4)防止作物虫害
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列制备和收集气体的实验装置合理的是( )
A. 用氯化铵和氢氧化钙制NH3 
B. 用MnO2 和浓盐酸制氯气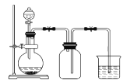
C. 用锌粒和稀硫酸制氢气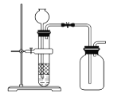
D. 用双氧水和二氧化锰制氧气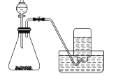
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下各组微粒或物质:A.正丁烷和异丁烷;B.金刚石、石墨和C60;C.冰和干冰;D.35Cl和37Cl;E.NO和NO2;其中,互为同分异构体的有__________(填编号,以下同);互为同素异形体的有__________;互为同位素的有__________。
(2)现有:①干冰;②金刚石;③NH4Cl;④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(3)向一个容积为2 L的密闭容器中充入7 mol SO2和4 mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com