
| A、25℃时,NaB溶液的pH=9,则c(Na+)-c(B-)=9.9×10-7mol?L-1 |
| B、0.1mol?L-1的NaHCO3溶液中:c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| C、25℃时,向0.1mol?L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| D、25℃时,将pH均为3的醋酸溶液和盐酸分别加水稀释到pH均为5,则由水电离出的H+的浓度均减小为原来的100倍 |


科目:高中化学 来源: 题型:
| A、用氨水可以鉴别MgCl2溶液和AlCl3溶液 |
| B、SO2能使新制氯水和KMnO4溶液褪色 |
| C、金属钠与CuSO4溶液反应能析出单质Cu |
| D、可以用澄清的石灰水鉴别Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯分子中碳碳双键的键长大于乙烷分子中碳碳单键的键长 |
| B、乙稀分子中碳、氢原子都处在同一平面上,而乙烷分子中的碳.氢原子不处在同一平面上 |
| C、乙烯和乙烷分子中碳氢键的键角都是120° |
| D、乙烯分子中碳碳双键的键能大于乙烷分子中碳碳单键的键能,但略小于碳碳单键的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
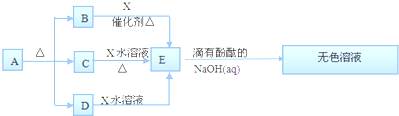
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ |
| B、Mg2+ |
| C、Fe2+ |
| D、A13+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、Fe3+、SO42-、HCO3- |
| B、b点对应的溶液中:Na+、S2-、SO42-、Cl- |
| C、c点对应的溶液中:K+、Ag+、Ca2+、NO3- |
| D、d点对应的溶液中:K+、NH4+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2O |
| B、NO |
| C、NO2 |
| D、N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、④⑤⑥ |
| C、④⑥⑦ | D、③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com