
【题目】将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的 乙装置,红色布条不褪色,则甲装置中所盛试剂可能是

①浓硫酸 ②饱和食盐水 ③水 ④NaOH溶液
A. ①② B. ②③ C. ①④ D. ②③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M,常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。M属于芳香族化合物,苯环上只含有一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162g·mol-1,只含碳、氢、氧,且原子个数之比为5:5:1。
(1)肉桂酸甲酯的结构简式是______________________。
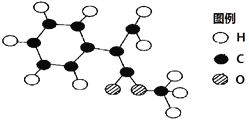
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。G的结构简式为_________________。
(3)用芳香烃A为原料合成G的路线如下:
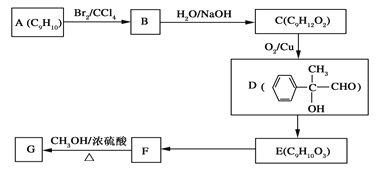
①化合物E中的官能团有________(填名称)。
②E→F的反应类型是________,
F→G的化学方程式为__________________________________________________。
③写出两种符合下列条件的F的稳定的同分异构体的结构简式_________________。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.在催化剂作用下,1mol该物质与足量氢气充分反应,最多消耗5mol H2;
ⅲ.它不能发生水解反应,但可以发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是__________________。
(2)实验室可以用铜和稀硝酸反应制取NO,反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑ +4H2O
①该反应中还原剂为__________
②氧化剂与还原剂之比是__________
③如果反应中转移了0.15mol电子,则产生的气体在标准状况下体积为______________
④用双线桥标出该反应转移电子数目情况_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是燃料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯的装置如图所示(加热和固定仪器的装置略去)。回答下列问题:
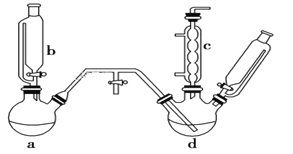
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是________(填字母序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是______________________。
(3)装置c出口的气体成分有HCl、Cl2、水蒸气和_____。
(4)制取氯苯的化学方程式为_______________________ 。
(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要水洗,其目的是______________________________。
②用10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为_____________________。
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸气,请画出该装置图,并标明所用试剂________。
(7)工业生产中苯的流失情况如下表所示:
项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
苯流失量kg/t | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
则10t苯可制得成品氯苯________t(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氮和肼(N2H4)是两种最常见的氮氢化物。
已知:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是______(填字母代号)。
A.c(CO)=c(CO2)
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
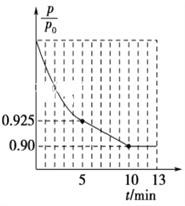
②图1为容器内的压强(p)与起始压强(p0)的比值![]() 随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
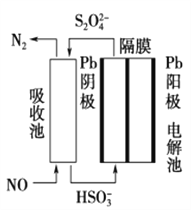
(3)使用间接电化学法可处理燃烧烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________________。用离子方程式表示吸收池中除去NO的原理____________________________________________。
【答案】 4NH3(g)+O2(g)2N2H4(g)+2H2O(g)ΔH=+526.2 kJ·mol-1 K1/K22 D 0.006 mol·L-1·min-1 80% 2HSO3-+2e-+2H+===S2O42-+2H2O 2NO+2S2O42-+2H2O===N2+4HSO3-
【解析】(1)①4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=![]() ,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol;
,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol; ![]() ;
;
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①A.c(CO)=c(CO2),不表示浓度变化,不能判断是否为平衡状态,故A错误;B.反应中气体的质量不变,体积不变,容器中混合气体的密度始终不变,不能判断是否为平衡状态,故B错误;C.v(N2)正=2v(NO)逆表示,应该是2v(N2)正=v(NO)逆,才表示正逆反应速率相等,故C错误;D.该反应属于气体的物质的量发生变化的反应,容器中混合气体的平均摩尔质量不变时表示气体的物质的量不变, 说明是平衡状态,故D正确;故选D;
②根据容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线,0~5min内,![]() =0.925,根据阿伏伽德罗定律及其推论,
=0.925,根据阿伏伽德罗定律及其推论,![]() =0.925,平衡时
=0.925,平衡时![]() =0.90,
=0.90,
2NO(g)+ 2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol) 0.1 0.3 0 0
反应 2x 2x x 2x
5min及平衡 0.1-2x 0.3-2x x 2x
5min时,![]() =0.925,解得x=0.03mol,v(N2)=
=0.925,解得x=0.03mol,v(N2)=![]() = 0.006mol·L-1·min-1;平衡时,
= 0.006mol·L-1·min-1;平衡时,![]() =0.90,解得x=0.04mol,NO的转化率=
=0.90,解得x=0.04mol,NO的转化率=![]() ×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O;硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O═N2+4HSO3-;故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-。
【题型】填空题
【结束】
10
【题目】锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:
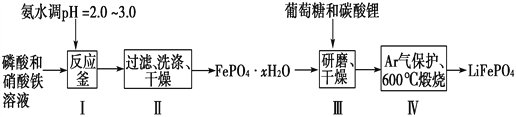
已知:Ksp(FePO4·xH2O)=1.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是________________。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的________等离子。
(3)取3组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
实验序号 | 1 | 2 | 3 |
固体失重质量分数 | 19.9% | 20.1% | 20.0% |
固体失重质量分数=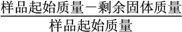 ×100%,则x=_______(精确至0.1)。
×100%,则x=_______(精确至0.1)。
(4)步骤Ⅲ中研磨的作用是__________________________________。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________。
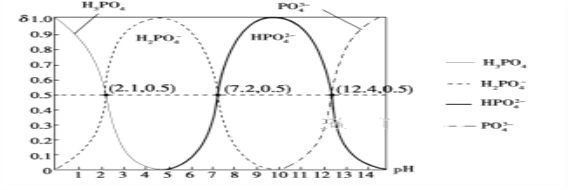
(6)H3PO4是三元酸,如图是常温下溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。则PO![]() 第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸桂酯(G)具有风仙花香气味,可用于调配果味食品香精及日用化妆品香精。一种用芳香烃A合成F的工艺路线如下:

回答下列问题:
(1)E结构简式为____________。C的名称是____________
(2)①的“反应条件”为________;②的反应类型为__________.
(3)F中所含官能团的名称为___________
(4)写出F![]() G反应的化学方程式___________
G反应的化学方程式___________
(5)F的同分异构体中,同时满足下列条件的有__种(不考虑立体异构);①能与FeCl3溶液显蓝紫色,②苯环上有两个取代基,含一个碳碳双键。其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:3的结构简式为__________.
(6)观察本题合成路线的试剂及条件,利用以上合成路线中的相关信息,请写出由HCHO、CH3CHO、制备CH2=CHCH2OOCCH3的合成路线图。(反应物及产物写成结构简式)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约______mol·L-1(小数点后保留一位)。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=______mol·L-1。
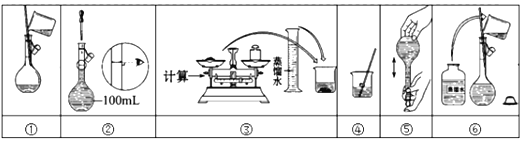
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制80mL含NaClO质量分数为25%的消毒液。需要称量NaClO固体的质量为_______g。下列为打乱了的操作示意图,其正确排序为_______________________。
(4)配制过程中下列各项操作对消毒液物质的量浓度有和影响(填“偏小”、“偏大”或“无影响”)
A.用托盘天平称量 NaClO固体时,砝码生锈__________________。
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水____________________。
C.定容时,俯视容量瓶刻度线进行定容 ___________________。
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为____________________;LiBH4中Li、B、H元素的电负性由大到小的排列顺序为_________________。
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为____________。

(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键__________(填“是”或“否”);与NH3BH3互为等电子体的分子的化学式为__________。
②B、C、N与O元素的第一电离能由大到小的顺序为___________________。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则立方氮化硼晶体可用作___________(选填下列字母序号)。
a.切削工具 b.钻探钻头 c.导电材料 d.耐磨材料
(3)一种有储氢功能的铜合金晶体具有面心立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。
①若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为________________;
②铜与其它许多金属及其化合物都可以发生焰色反应,其原因是_______________。
(4)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
①该金属元素是___________(填元素符号)..
②若氢化物的晶胞结构如图所示(有4个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为__________cm3[用含ρ、NA的代数式表示(其中NA为阿伏加德罗常数的值)]。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com