
镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素,镓的原子序数为31,属ⅢA元素,镓的熔点为29.78℃,沸点高达2 403℃,镓有过冷现象(即冷至熔点以下不凝固),它可过冷到-120℃。下列有关镓的性质及其用途的叙述不正确的是 ( )
A.镓是制造高温温度计的上佳材料
B.镓能溶于强酸强碱溶液中
C.镓与锌、锡等金属制成合金,可提高其硬度
D.镓可用于制造半导体材料,这是因为镓的导电性介于导体和绝缘体之间
科目:高中化学 来源: 题型:
25 ℃、101 kPa下:①2Na(s) + 1/2O2(g)= Na2O(s) ΔH1= - 414 kJ·mol-1
② 2Na(s)+O2(g) = Na2O2(s) ΔH2= - 511 kJ·mol-1 , 下列说法正确的是 ( )
A.①和②产物的阴阳离子个数 比不相等
比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ΔH= - 317 kJ·mol-1
D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
将等体积的HnRO3和Hn+1RO4两种酸溶液与定量的NaOH中和都生成正盐,则这两种酸的物质的量浓度比是( )
A.n∶(n+1) B.1∶1
C.1∶(n+1) D.( n+1)∶n
n+1)∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
我省盛产矿盐(主要成分是NaCl,还好有SO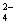 等其他可溶性杂质的离子)。下列有关说法正确的是
等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能大量共存的是( )
A.Fe3+、S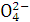 、Cl-、Na+ B.Ba2+、Mg2+、C
、Cl-、Na+ B.Ba2+、Mg2+、C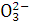 、Cl-
、Cl-
C.S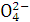 、Na+、K+、C
、Na+、K+、C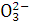 D.S
D.S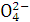 、K+、Cl-、OH-
、K+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
在四种化合物①NaHCO3、②Al(OH)3、③Al2O3、④NaAlO2中,与盐酸和氢氧化钠溶液都能反应的是( )
A.只有②④ B.只有①②
C.只有①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合氯化铝晶体是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
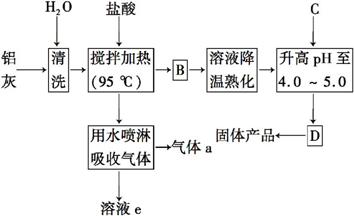
(1)反应中副产品a是 (用化学式表示)。
(2)升高pH至4.0~5.0的目的是______ 。
(3)生产过程中可循环使用的物质是 (用化学式表示)。
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用 (填编号)。
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为
[Al2(OH)nCl6-n·xH2O]m,实验室测定n的值:
①称取ag晶体,制成粉末,加热至质量不再变化为止,称量为bg。此过程可能用到的下列仪器有______ 。
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取ag晶体,进行如下操作:
用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为cg。A试剂为_______(填试剂名称),C操作为 (填操作名称)。n= (用含b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列氧化还原反应设计一个原电池:2FeCl3+Fe=3FeCl2
要求:(1)画出此原电池的装置图,装置可采用烧杯和盐桥。
(2)注明原电池的正、负极和外电路中电子的流向。
(3)写出两个电极上发生的电 极反应。
极反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com