
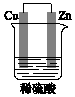
 某原电池装置如图所示.
某原电池装置如图所示.分析 该原电池中,锌易失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电子由负极沿导线流向正极,据此分析解答.
解答 解:(1)该原电池中,锌易失电子发生氧化反应而作负极,故答案为:Zn;氧化;
(2)铜作正极,正极上氢离子得电子发生还原反应生成氢气,所以正极上的现象是有无色气泡产生,故答案为:有无色气泡产生;
(3)电子由负极沿导线流向正极,所以电子由锌片沿导线流出,故答案为:锌片;
(4)电池的总反应是锌与硫酸发生的氧化还原反应,反应方程式为:Zn+H2SO4═ZnSO4+H2↑,故答案为:Zn+H2SO4═ZnSO4+H2↑.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,注意把握原电池的工作原理,把握电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,苯酚可以和甲醛发生加聚反应生成酚醛树脂 | |
| B. | 聚丙烯酸钠属于功能高分子材料,具有较强的吸水性 | |
| C. | 酶是具有催化作用的蛋白质,在光、热、酸、碱、重金属离子、乙醇等作用下会失去活性 | |
| D. | 淀粉溶液、肥皂水都是胶体,都有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.
海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.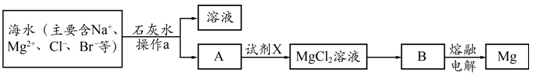
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H
(g)+HCl(g)△H| t/min | 0 | 1 | 2 | 5 | 10 |
| n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
| A. | 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol•L-1•min-1 | |
| B. | 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol•L-1,则反应的△H>0 | |
| C. | 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 molα-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行 | |
| D. | 在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1 mol•L-1的氨水中有0.1NA个NH4+ | |
| B. | 标准况下,22.4L盐酸含有NA个HCl分子 | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为0.5 NA | |
| D. | 标准状况下,6.72 LN02与水充分反应转移的电子数目为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com