
| 实验序号号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
| 1 | 100 | 17.2 | 2.24 |
| 2 | 200 | 8.00 | 4.48 |
| 3 | 400 | 0 | V |
| A. | 表中 V=7.84 L | |
| B. | 原混合物粉末的质量为25.6 g | |
| C. | 原混合物粉未中铁和铜的物质的量之比为2:3 | |
| D. | 实验3所得溶液中硝酸的物质的量浓度为0.875 mol•L-1 |
分析 由第一组数据可知固体有剩余.无论硝酸和什么金属反应,根据N原子守恒得,n(HNO3)=4 n(NO),加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,所以c(HNO3)=4mol/L,由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体(转移0.3 mol电子),若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,所以第一次实验后剩余金属为Fe和Cu.第二次实验后剩余金属只有铜,由此分析解答.
解答 解:由第一组数据可知固体有剩余.无论硝酸和什么金属反应,根据N原子守恒得,n(HNO3)=4 n(NO),加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,所以c(HNO3)=4mol/L,由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体(转移0.3 mol电子),若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g,由此可知这9.2 g中应有Fe和Cu两种金属,设Fe和Cu的物质的量分别为xmol和ymol,则$\left\{\begin{array}{l}{56x+64y=9.2}\\{2x+2y=0.3}\end{array}\right.$,解之得$\left\{\begin{array}{l}{x=0.05}\\{y=0.1}\end{array}\right.$,所以9.2gk中含铁2.8g,含铜的质量为:6.4g,所以第一次实验后剩余金属为Fe和Cu,而第二次实验后剩余金属只有铜,所以每一份固体混合物的质量为:$\frac{2.24}{22.4}×3×\frac{1}{2}×56+17.2$=25.6g,其中含铁为8.4+2.8=11.2g,含铜的质量为:6.4+8=14.4g,所以铁和铜的物质的量之比为$\frac{11.2}{56}:\frac{14.4}{64}$=8:9,
A、铁和铜完全反应消耗硝酸的物质的量为:$\frac{\frac{11.2}{56}×3}{3}+\frac{\frac{14.4}{64}×2}{3}$+$\frac{11.2}{56}×3+\frac{14.4}{64}×2$=1.4mol,所以400mL的硝酸的物质的量为0.4×4=1.6mol,则硝酸过量,所以V=$\frac{\frac{11.2}{56}×3+\frac{14.4}{64}×2}{3}×22.4$=7.84L,故A正确;
B、原混合物粉末的质量为25.6 g×3=76.8g,故B错误;
C、铁和铜的物质的量之比为:$\frac{11.2}{56}:\frac{14.4}{64}$=8:9,故C错误;
D、实验3所得溶液中硝酸的物质的量浓度为$\frac{1.6-1.4}{0.4}$=0.5mol/L,故D错误;
故选A.
点评 本题考查混合物的有关计算,根据表中数据判断各阶段发生的反应是解题关键,侧重对学生综合能力的考查,题目难度中等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④②③ | B. | ④②①③ | C. | ③②①④ | D. | ④②③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.4 | B. | 28.4 g/mol | C. | 64 | D. | 64 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
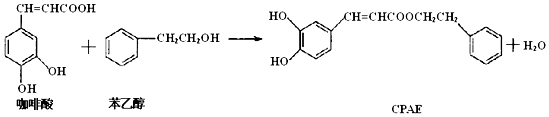
| A. | 咖啡酸分子中所有碳原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的溴水反应,最多消耗3molBr2 | |
| C. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 | |
| D. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用大阳能制氢时,若光解0.02molH2O可生成H2的质量为0.02g | |
| B. | 用生氢剂CaH2与水反应制氢时,生成1mol H2时转移电子致目为2NA | |
| C. | 常温常压下,4.0g氢氧化钠溶于1L水所得溶液c(NaOH)=0.10mol/L | |
| D. | 标准状况下,22.4LCH3Cl中含有的共用电子对数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将 0.1 mol 氨充分溶解在 1 L 水中 | |
| B. | 将 10 g 质量分数为 98%的硫酸与 990 g 水混合 | |
| C. | 将 8 g 三氧化硫溶于水并配成 1 L 溶液 | |
| D. | 将 0.1 mol 氧化钠溶于水并配成 1L 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4、NaOH--腐蚀品 | B. | CH4--易燃液体 | ||
| C. | Na--遇湿易燃物品 | D. | KMnO4--氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com