
| ||
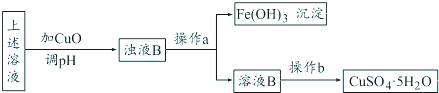
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
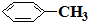 e.
e.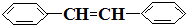 f.
f.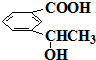
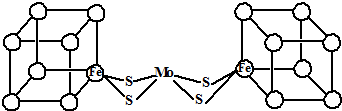
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1MPa | 2MPa | 3MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)<K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
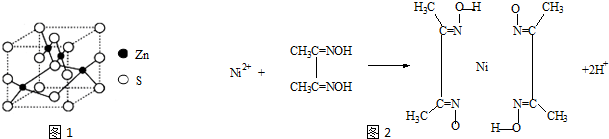
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干冰可以用于人工降雨 |
| B、推广使用可降解塑料,有助于减少“白色污染” |
| C、将熟石灰和硝酸铵混合施用,肥效更高 |
| D、环境保护应从源头消除污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性强弱:HClO>H2SO4>H2CO3 |
| B、热稳定性:HF>HCl>HBr |
| C、已知硒(Se)与硫同主族,其最高价氧化物对应的水化物分子式为:H2SeO3 |
| D、原子半径大小:Na>P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
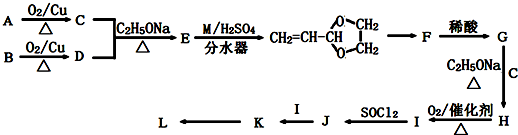
| C2H5ONa |
| △ |
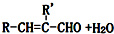
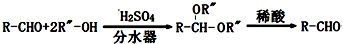
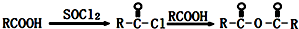
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com