
【题目】t℃时,在体积不变的容器中发生反应X(g)+3Y(g) ![]() aZ(g) △H<0,各组分浓度如下表
aZ(g) △H<0,各组分浓度如下表
物质 | X | Y | Z |
初始浓度/ mol·L-1 | 0.1 | 0.3 | 0 |
2min末浓度/mol·L-1 | 0.08 | 0.04 | |
平衡浓度/mol·L-1 | 0.1 |
(1)0~2min的平均速率ν(Y) =___________________
(2)达平衡时X的转化率为___________________
(3)a =_______________
(4)平衡时Y的浓度为________________
(5)下列能表示该反应一定达到平衡状态的______________
①单位时间内生成n mol X的同时生成n mol Z
②c(X):c(Y):c(Z)的比值不再变化
③容器中的气体的质量不再变化
④容器中混合气体的平均相对分子质量不再变化
【答案】0.03 mol·L-1·min-1 50% 2 0.15mol·L-1 ②④
【解析】
X(g) + 3Y(g) ![]() aZ(g)
aZ(g)
初始浓度/ mol·L-1 0.1 0.3 0
变化浓度/ mol·L-1 0.02 0.06 0.04
2min末浓度/mol·L-1 0.08 0.24 0.04
根据反应速率之比等于相应的化学计量数之比,可知a=2;
X(g) + 3Y(g) ![]() 2Z(g)
2Z(g)
初始浓度/ mol·L-1 0.1 0.3 0
变化浓度/ mol·L-1 0.05 0.15 0.1
平衡浓度/mol·L-1 0.05 0.15 0.1
(1) 由分析可知,0~2min的平均速率ν(Y)=![]() =0.03 mol·L-1·min-1;
=0.03 mol·L-1·min-1;
(2) 由上述计算可知,达平衡时X的转化率为![]() ×100%=50%;
×100%=50%;
(3) 由分析可知,a=2;
(4) 由上述计算可知,平衡时Y的浓度为0.15mol·L-1;
(5) 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断。
①单位时间内生成n mol X的同时生成n mol Z,正逆反应速率不相等,故①错误;
②未达到平衡时c(X):c(Y):c(Z)的比值会一直变化,当c(X):c(Y):c(Z)的比值不再变化时,可判断反应达到了平衡状态,故②正确;
③该反应的反应物和生成物均为气体,由质量守恒定律可知,容器中的气体质量一直不会变化,故容器中的气体的质量不再变化,不能判断反应达到了平衡状态,故③错误;
④M=![]() ,该反应是前后气体数目不相等的反应,未达到平衡时容器中混合气体的平均相对分子质量一直在改变,所以当容器中混合气体的平均相对分子质量不再变化时,可判断反应达到了平衡状态,故④正确;
,该反应是前后气体数目不相等的反应,未达到平衡时容器中混合气体的平均相对分子质量一直在改变,所以当容器中混合气体的平均相对分子质量不再变化时,可判断反应达到了平衡状态,故④正确;
答案选②④。


科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
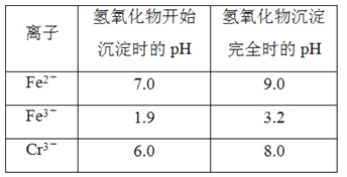
(1)某含铬废水处理的主要流程如图所示:
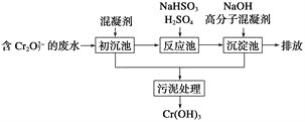
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
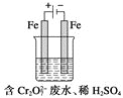
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭恒容容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的密度不再发生变化 ②v正(Y)= 2v逆(X) ③容器中的压强不再发生变化 ④单位时间内生成nmol Z,同时生成2nmolY
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素化合物在生产生活中有很多应用,写出与下列应用相关的化学方程式 。
(1)漂白粉生效原理______________________________________________
(2)粗硅的制取___________________________________________________
(3)过氧化氢氧化碘离子___________________________________________
(4)实验室制取氨气_______________________________________________
(5)过量二氧化硫与澄清石灰水反应_____________________________________________
(6)氯碱工业生产氯气_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=[(CO2)·(H2)]/[(CO)·(H2O)]在不同的温度下该反应的平衡常数如下表所示:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
C. 某温度下,如果平衡浓度符合下列关系式:(CO2)/3(CO)=(H2O)/5(H2),判断此时的温度是1 000 ℃
D. 该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的、以离子形式存在的碘元素。如图是实验室从海藻里提取碘的流程中的一部分。

下列判断正确的是( )
A.步骤①③的操作分别是过滤、萃取
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加入的有机溶剂是四氯化碳或乙醇
D.步骤④的操作是过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为________________________。
(2)已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
Ⅱ.已知水的电离平衡曲线如图所示,试回答下列问题:
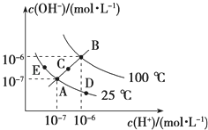
(3)图中五点KW间的关系是__________________.
(4)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(5)E对应的温度下,在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:________,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com