

分析 (1)根据盖斯定律来计算反应的焓变,根据热化学方程式的书写规律来书写热化学方程式;
(2)根据v=$\frac{△c}{△t}$计算二氧化碳的平均反应速率,再结合同一时间段内同一可逆反应中,各物质的反应速率之比等于其计量数之比计算一氧化碳的平均反应速率;
(3)根据平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值进行解答;
(4)CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2kJ•mol-1,该反应升高温度逆向移动,前后气体的物质的量不变,压强变化不影响平衡移动,增加反应物浓度正向移动,减少生成物浓度正向移动;
(5)该温度下,此反应的化学平衡常数为$\frac{9}{49}$,根据浓度商Qc=$\frac{C(CO{\;}_{2})C(H{\;}_{2})}{C(CO)C(H{\;}_{2}O)}$与平衡常数K大小分析判断,Qc<K,平衡向正反应进行,Qc>K,平衡向逆反应进行,Qc═K,达平衡.
解答 解:(1)根据第一步反应过程可以得出:CH4(g)+H2O(g)=3H2(g)+CO(g),△H=-103.3kJ•mol-1;根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2kJ•mol-1;根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ•mol-1,
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ•mol-1;
(2)根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2kJ•mol-1;v(CO2)=$\frac{△c}{△t}$=$\frac{0.03mol/L}{10min}$=0.003mol/(L.min),根据同一时间段内同一可逆反应中,各物质的反应速率之比等于其计量数之比计算一氧化碳的平均反应速率,所以v(CO)=v(CO2)=0.003mol/(L.min),
故答案为:0.003 mol•L-1•min-1;
(3)利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.1 mol•L-1 0.1 mol•L-1 0 0
转化:0.03 mol•L-1 0.03 mol•L-1 0.03 mol•L-1 0.03 mol•L-1
平衡:0.07 mol•L-1 0.07 mol•L-1 0.03 mol•L-1 0.03 mol•L-1
因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=$\frac{C(CO{\;}_{2})C(H{\;}_{2})}{C(CO)C(H{\;}_{2}O)}$=$\frac{0.03×0.03}{0.07×0.07}$=$\frac{9}{49}$,
故答案为:$\frac{9}{49}$;
(4)CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2kJ•mol-1,
A.升高温度单位体积内活化分子数目增多,反应速率增大,平衡向吸热反应方向移动,该反应逆反应为吸热反应,所以平衡逆向移动,故A错误;
B.该反应前后气体的物质的量不变,压强变化不影响平衡移动,故B错误;
C.水为反应物,增大H2O(g)的浓度,反应速率增大,平衡向降低H2O(g)浓度的方向移动,所以平衡正向移动,故C正确;
D.CO2(g)为生成物,减少CO2(g)的浓度,平衡向减弱CO2(g)浓度降低的方向移动,所以平衡正向移动,故D正确;
故答案为:CD;
(5)利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:1 mol•L-1 2 mol•L-1 0 0
转化:0.4 mol•L-1 0.4mol•L-1 0.4 mol•L-1 0.4 mol•L-1
平衡:0.6 mol•L-1 1.6 mol•L-1 0.4 mol•L-1 0.4 mol•L-1
浓度商Qc═$\frac{C(CO{\;}_{2})C(H{\;}_{2})}{C(CO)C(H{\;}_{2}O)}$=$\frac{0.4×0.4}{0.6×1.6}$=$\frac{1}{6}$<K,平衡向正反应进行,v(正)>v(逆),
故答案为:正方向,Qc═$\frac{C(CO{\;}_{2})C(H{\;}_{2})}{C(CO)C(H{\;}_{2}O)}$=$\frac{0.4×0.4}{0.6×1.6}$=$\frac{1}{6}$<K,所以该反应向正反应方向进行.
点评 本题考查反应速率的计算、化学平衡有关计算、化学平衡移动与影响因素等,注意平衡常数的应用、平衡移动的本质是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
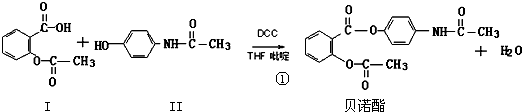
 ,反应④的反应类型为取代反应.
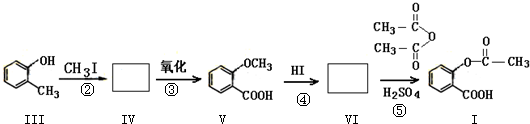
,反应④的反应类型为取代反应.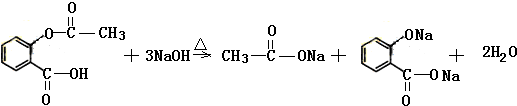 .
. .
. 在
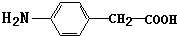
在 催化作用下也能与扑热息痛(Ⅱ)发生类似①的反应,产物的结构简式为:
催化作用下也能与扑热息痛(Ⅱ)发生类似①的反应,产物的结构简式为: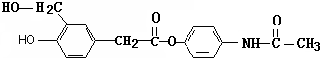 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;苯酚是医院常用的消毒剂,由于其有强烈的腐蚀作用,能腐蚀皮肤、气管,能使蛋白质变性,所以必须小心使用.中学化学常用浓溴水检验苯酚,请写出该反应的化学方程式
;苯酚是医院常用的消毒剂,由于其有强烈的腐蚀作用,能腐蚀皮肤、气管,能使蛋白质变性,所以必须小心使用.中学化学常用浓溴水检验苯酚,请写出该反应的化学方程式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与盐酸反应:2Fe+6H+═3H2↑+2 Fe3+ | |
| B. | 将铜片投入硫酸溶液中:Cu+2H+═H2↑+Cu2+ | |
| C. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 向澄清石灰水中滴入少量碳酸氢钠溶液:HCO${\;}_{3}^{-}$+OH-+Ca2+═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、OH-、NO3-、K+ | B. | H+、HCO3-、Ca2+、NO3- | ||
| C. | Cl-、OH-、H+、K+ | D. | Cu2+、SO42-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)(红棕色)???N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | H2(g)+I2(g)???2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 | |
| C. | FeCl3+3KSCN???Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | 对于N2+3H2???2NH3,平衡后,压强不变,充入O2,平衡左移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com