
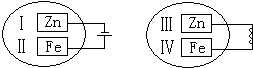
 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,观察到的现象和对应方程式都正确的是( )
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,观察到的现象和对应方程式都正确的是( )| A、Ⅰ附近溶液变红,Zn-2e-=Zn2+ |
| B、Ⅳ附近溶液变红,O2+2H2O+4e-=4OH- |
| C、Ⅱ附近有黄绿色气体生成,2Cl--2e-=Cl2↑ |
| D、Ⅲ附近有无色气体生成,2H++2e-=H2↑ |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| A、原反应物中CuO与Fe2O3物质的量的比为1:1. |
| B、反应后所得CO2的质量为40g |
| C、参加反应的CO的质量为11.2g |
| D、原反应物中CuO与Fe2O3物质的量的比为1:2. |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.5% | B、25% |
| C、50% | D、75% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有0.1 mol?L-1Fe3+的溶液中:K+、Mg2+、SCN-、SO42- |
| B、0.1 mol?L-1NaAlO2溶液:S2-、Na+、HCO3-、SO42- |
| C、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| D、水电离产生的c(H+)=10-12mol?L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CO32-)>c(H2CO3) |
| B、c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、c(Na+)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
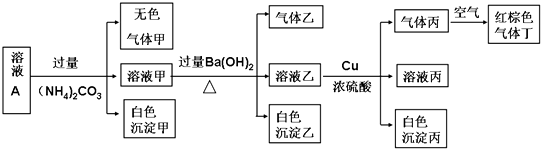
| A、沉淀乙一定有BaCO3,可能有BaSO4 |
| B、实验消耗Cu 14.4g,则生成气体丁的体积为3.36L |
| C、该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 |
| D、生成的甲、乙、丙气体均为无色的易溶于水气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com