
A、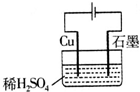 如图所示通电一段时间后,石墨电极上会有铜析出 |
| B、在原电池的负极和电解池的阴极上都发生氧化反应 |
| C、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
| D、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为2:1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应的反应速率一定大于吸热反应的反应速率 |
| B、熔融状态下能导电的化合物一定含离子键 |
| C、增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加热 |
 根据题意完成下列填空:有关数据列表如下:
根据题意完成下列填空:有关数据列表如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NH4+ 中含有质子数为NA |
| B、26g 乙炔中含有π键数为2NA |
| C、标准状况下,22.4L SO3 中所含分子数为NA |
| D、1L 0.1mol/L NaHCO3 溶液中所含氧原子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | c(HA)/mol?L-1 | c(NaOH)/mol?L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A、a<9 |
| B、c1<0.2 |
| C、在乙组混合溶液中c(OH-)-c(HA)=10-9 mol/L |
| D、在丁组混合液中c(Na+)<c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验及现象 | 可能的原因 | |
| A | 向氯化亚铁溶液中滴加几滴硫氰化钾溶液,再通人氯气,最后溶液不呈红色 | 过量的氯气将硫氰化钾氧化 |
| B | 点燃从玻璃导管导出的甲烷时,看到黄色火焰 | 玻璃中含有钠元素 |
| C | 新配制的氢氧化铜浊液中加入乙醛溶液并加热有黑色沉淀生成 | 温度过高使乙醛脱水碳化 |
| D | 用锌粒和稀硫酸制备氢气时,加入几滴硫酸铜溶液后,产生气体的速度大大加快 | 形成了原电池,反应速率加快 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com