
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
分析 ①活泼的金属易与水反应的,不能作电极;
②根据原电池的构成条件分析;
③原电池是将化学能转化为电能的装置;
④原电池中Fe作负极失电子生成亚铁离子.
解答 解:①活泼的金属易与水反应,不能作电极,故错误;
③原电池的构成条件①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,若有活泼性不同的两种金属电极、有电解质溶液、导线,如果不能自发发生氧化还原反应,则不能形成原电池,故错误;
③原电池反应中能自发的进行氧化还原反应,是将化学能转化为电能的装置,故正确;
④以铁、铜为电极,在稀硫酸溶液中构成原电池,Fe作负极失电子生成亚铁离,负极反应式为Fe-2e-═Fe2+,故错误;
故选C.
点评 本题考查了原电池的构成和电极方程式的判断,属于基础性试题的考查,题目难度不大,明确原电池的工作原理、构成条件是答题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)<c(OH-) | B. | c(H2C2O4)>c(C2O42-) | ||
| C. | c(H2C2O4)+c(H+)═c(C2O42- )+c(OH-) | D. | c(Na+)+c(H+)═c(HC2O4-)+c(C2O42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ④⑤⑧⑩ | C. | ②⑤⑦⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳与氧气 | B. | 氢氧化钠溶液与二氧化碳 | ||
| C. | 钠与氧气 | D. | 氢气与氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
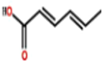
| A. | 该有机物与等物质的量Br2发生加成反应时,可生成两种加成产物 | |
| B. | 该有机物能与金属Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液发生反应 | |
| C. | 该有机物能发生加成、取代、氧化、消去、加聚反应 | |
| D. | 可使用酸性高锰酸钾溶液鉴别该有机物和乳酸(2-羟基丙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com