
【题目】根据下列反应框图填空。已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应(E能引起温室效应)。
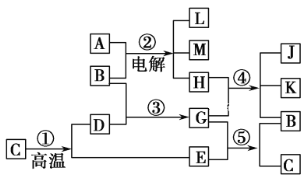
(1)单质L是________;化合物A是________。
(2)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。它们反应的化学方程式分别是:____________________和_____________________。
(3)E和K、J混合溶液反应的化学方程式为_______________________________。此反应的发生说明了___________________________________________________________。
(4)把K、J混合固体放入少量浓盐酸中,则其反应的现象是____________。
【答案】H2 NaCl ② ④ 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O Ca(ClO)2+CO2 +H2O =CaCO3↓+2HClO 符合强酸制取弱酸的原理,酸性H2CO3>HClO 有黄绿色气体生成
2NaOH+H2↑+Cl2↑ 2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O Ca(ClO)2+CO2 +H2O =CaCO3↓+2HClO 符合强酸制取弱酸的原理,酸性H2CO3>HClO 有黄绿色气体生成
【解析】
由题意可知,E为引起温室效应的气体,则E为CO2;由⑤是实验室鉴定CO2的反应,可知G为Ca(OH)2,B为H2O,反应①是高温分解石灰石的反应,C为CaCO3,D为CaO;则反应②是电解饱和食盐水:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。
2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。
由题意可知,E为引起温室效应的气体,则E为CO2;由⑤是实验室鉴定CO2的反应,可知G为Ca(OH)2,B为H2O,反应①是高温分解石灰石的反应,C为CaCO3,D为CaO;则反应②是电解饱和食盐水:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。
2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。
(1)由以上分析可知L为H2,A为NaCl,故答案为:H2;NaCl;
(2)图中除反应①以外,反应②用于工业上制烧碱,反应④用于工业上制漂白粉,反应的化学方程式分别是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑和2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑和2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,故答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
(3)E和K、J混合溶液的反应是漂白粉漂白原理反应,是利用强酸制取弱酸的原理,由酸性强的H2CO3与次氯酸钙反应制取酸性较弱的HClO,反应的化学方程式为2Ca(OH)2+CO2=CaCO3↓+2HClO,故答案为:2Ca(OH)2+CO2=CaCO3↓+2HClO;符合强酸制取弱酸的原理,酸性H2CO3>HClO;
(4)向漂白粉中放入少量浓盐酸中,次氯酸钙与浓盐酸发生氧化还原反应,生成黄绿色的氯气,反应的化学方程式为:Ca(ClO)2+4HCl(浓)= CaCl2+ 2Cl2↑+2H2O,故答案为:有黄绿色气体生成。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=-58 kJmol-1,则ΔH3=______。
已知:CO中的化学键是C≡O,CH3OH的结构式为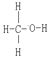 。
。
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s)+O2(g)=CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH=______kJ·mol-1。
(3)中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
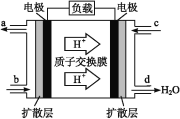
①该电池工作时,b口通入的物质为___。
②该电池正极的电极反应式为______________。
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有____NA个电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新版人民币的发行,引发了人们对有关人民币中化学知识的关注。下列表述不正确的是( )
A. 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
B. 用于人民币票面文字等处的油墨中所含有的![]() 是一种磁性物质
是一种磁性物质
C. 某种化学验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉
D. 防伪荧光油墨由颜料与树脂连接料等制成,树脂与油脂一样,属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
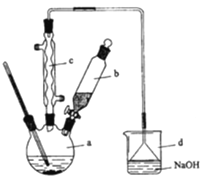
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了_________气体,继续滴加至液溴滴完。装置d的作用是_________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是_________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是_________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是_____________(填入正确选项前的字母):
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
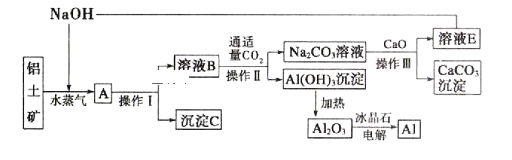
请回答下列问题。
(1)沉淀C的化学式为_______________,该物质除了用于金属冶炼以外,还可用作____________。
(2)电解熔融的氧化铝时,若得到22.4L(标准状况下)![]() ,则同时生成___________g铝。
,则同时生成___________g铝。
(3)操作I、操作II和操作III都是__________(填操作名称),实验室要洗涤,![]() 沉淀应该在____________装置中进行,洗涤方法是_____________________________。
沉淀应该在____________装置中进行,洗涤方法是_____________________________。
(4)生产过程中,除NaOH、![]() 可以循环利用外,还可以循环利用的物质有______________(填化学式),用此法制取铝的副产品是_______________(填化学式)。
可以循环利用外,还可以循环利用的物质有______________(填化学式),用此法制取铝的副产品是_______________(填化学式)。
(5)写出![]() 溶液与CaO反应的离子方程式:_________________________。
溶液与CaO反应的离子方程式:_________________________。
(6)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝中将混有杂质_______________(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是
A. 将78gNa2O2与过量CO2反应转移的电子数为2NA
B. 1mol N2与 4mol H2反应生成的NH3分子数为2NA
C. 标准状况下,2.24L SO3中所含原子数为0.4 NA
D. 标准状况下,18g D2O中所含电子数为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则
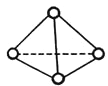
A. 1molN4气体转化为N2时要吸收217kJ能量 B. N4是N2的同位素
C. 1molN4气体转化为N2时要放出724kJ能量 D. N4是一种新型化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锂—空气电池的放电原理图(隔膜只允许锂离子通过)。电池放电时的反应可表示为:4Li+O2+2H2O=4LiOH。下列锂—空气电池放电时的有关说法正确的是( )

A. 正极反应式:Li-e-=Li+
B. 每转移2mol电子,消耗11.2L的O2
C. Li+不断向电池的正极移动
D. 可以去掉隔膜和有机电解液,让金属锂与水性电解液直接接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在科学史上中国有许多重大的发明和发现,它们为世界的现代化奠定了基础,以下发明和发现属于化学史上中国对世界的贡献的是( )
①火药 ②指南针 ③造纸 ④印刷技术 ⑤炼铜、炼铁、炼钢 ⑥合成有机高分子材料 ⑦人工合成蛋白质 ⑧提出原子-分子学说
A.②③⑥⑧B.①③⑤⑦C.④⑤⑦⑧D.①③④⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com