
分析 (1)计算NO物质的量,再计算NO2、N2O4总物质的量,气体全部为NO、NO2时,得到硝酸最少,气体为NO、N2O4时得到硝酸最多,结合N原子守恒计算;
(2)根据c=$\frac{1000ρω}{M}$计算98%浓硫酸密度、87%硫酸的物质的量浓度,再根据稀释定律计算吸水后硫酸体积,进而吸收水的质量;
(3)根据蒸馏过程中硝酸、硝酸镁质量不变,表示出蒸馏后97.5%的HNO3的质量、60%的Mg(NO3)2溶液质量,蒸馏后溶液质量之和=原溶液质量之和-损耗水的质量;
(4)根据N原子守恒计算n(NaNO3),NO、NO2和NaOH溶液反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O,结合方程式计算原混合气体中NO和NO2的物质的量,再根据氧原子守恒解答.
解答 解:(1)NO的物质的量为1.25mol×0.6=0.75mol,则NO2、N2O4总物质的量为1.25mol-0.75mol=0.5mol,
气体全部为NO、NO2时,得到硝酸最少,根据N原子守恒,得到硝酸极小值为1.25mol,
气体为NO、N2O4时得到硝酸最多,根据N原子守恒,得到硝酸极大值为0.75mol+0.5mol×2=1.75mol,
则:1.25mol<n(HNO3)<1.75mol,
故答案为:1.25mol<n(HNO3)<1.75mol;
(2)98%浓硫酸密度为$\frac{18.4×98}{1000×98%}$g/mL=1.84g/mL,
87%(密度1.8g/cm3)的硫酸物质的量浓度为$\frac{1000×1.8×87%}{98}$mol/L,
根据稀释定律,50mL浓硫酸吸水失去吸水能力后溶液体积为:$\frac{50mL×18.4mol/L}{\frac{1000×1.8×87%}{98}mol/L}$=57.57mL,
则吸收水的质量为:$\frac{50mL×18.4mol/L}{\frac{1000×1.8×87%}{98}mol/L}$×1.8g/mL-50mL×1.84g/mL=11.63g
故答案为:11.63;
(3)蒸馏后得到97.5%的HNO3的质量为$\frac{{m}_{1}×65%}{97.5%}$,得到60%的Mg(NO3)2溶液质量为$\frac{{m}_{2}×72%}{60%}$,损耗水的总质量为(m1+m2)×5%,则:
$\frac{{m}_{1}×65%}{97.5%}$+$\frac{{m}_{2}×72%}{60%}$=(m1+m2)-(m1+m2)×5%
整理可得:$\frac{{m}_{1}}{{m}_{2}}$=0.88
故答案为:0.88;
(4)根据N原子守恒得n(NaNO3)=n(NOx)-n(NaNO2)=0.5mol-0.35mol=0.15mol,
由 2NO2+2NaOH=NaNO2+NaNO3+H2O,可知生成0.15mol硝酸钠需要0.3molNO2,同时生成0.15mol亚硝酸钠,则反应NO+NO2+2NaOH=2NaNO2+H2O生成的亚硝酸钠为0.35mol-0.15mol=0.2mol,则该反应中消耗0.1molNO2、0.1molNO,所以原混合气体中NO、NO2的物质的量分别是0.1mol、0.4mol,尾气中NO与NO2的平均组成记为NOx,则x=$\frac{0.1mol×1+0.4mol×2}{0.5mol}$=1.8,
故答案为:1.8.
点评 本题考查混合物有关计算、溶液浓度计算,题目计算量大,属于易错题目,有利于培养学生的分析计算能力,注意极限法与守恒法的应用,难度中等.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | KOH | B. | Na2CO3 | C. | HClO4 | D. | MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 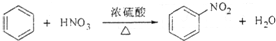 | |
| B. |  | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{?}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的平均分子量不再变化 | B. | 反应的平衡常数不变 | ||
| C. | ?(H2)=2 ?(HI) | D. | 气体的颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 2:15 | C. | 2:3 | D. | 16:25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
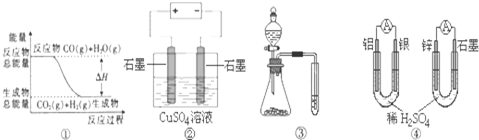
| A. | 图①表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H大于0 | |
| B. | 图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1 | |
| C. | 图③实验装置可完成比较磷酸、碳酸、苯酚的酸性强弱的实验 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用磨口玻璃瓶、玻璃塞保存NaOH溶液 | |
| B. | 加入适量的金属钠除去酒精中少量的水 | |
| C. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝色的气体一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com