
 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.分析 (1)类比氢氧化亚铁的性质回答即可;
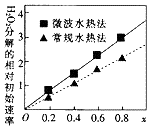
(2)过氧化氢的分解速率越大,催化剂活性更高;随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,据此进行分析;
(3)由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),根据化合价电荷守恒为0计算氧化物中n(O),进而计算氧化物中n(Co):n(O),结合原子守恒写出化学方程式;
(4)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:1、含有杂质,导致氯离子含量大,2、结晶水化物失去部分水;
解答 解:(1)Co(OH)2在空气中慢慢被氧化为棕褐色的Co(OH)3的方程式为:4Co(OH)2+O2+2H2O=4Co(OH)3,
故答案为:4Co(OH)2+O2+2H2O=4Co(OH)3;
(2)过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高,故答案为:微波水热;Co2+;
(3)由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{6.72L}{22.4L/mol}$=0.6 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×0.3mol)=0.9 mol,所以固体中的n(Co2+)=0.9mol-0.6mol=0.3 mol,根据化合价电荷守恒为0,氧化物中n(O)=(0.3mol×2+0.6mol×3)÷2=1.2mol,故该钴氧化物中n(Co):n(O)=0.9mol:1.2mol=3:4,故氧化物的化学式为:Co3O4,和盐酸反应的化学方程式为Co3O4+8HCl═3CoCl2+Cl2↑+4H2O,
故答案为:Co3O4+8HCl═3CoCl2+Cl2↑+4H2O;
故答案为:降低烘干温度,防止产品分解;
(4)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:1、含有杂质,导致氯离子含量大,2、结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,
故答案为:样品中含有NaCl杂质,CoCl2•6H2O烘干时失去了部分结晶水;
点评 本题考查学生对实验原理理解、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子数为3 | B. | 相对原子质量为2 | ||
| C. | 原子的核电荷数为3 | D. | 原子结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 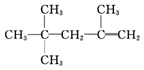 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 | |
| B. | 化合物 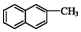 不是苯的同系物 不是苯的同系物 | |
| C. | 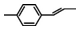 分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 | |
| D. | 除甲酸外的羧酸均不能使高锰酸钾酸性溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).
,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | 铜、二氧化硫 | ||
| C. | 熔融的KNO3、酒精 | D. | 液态的醋酸、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O2-离子的结构示意图: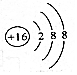 | |
| B. | 碳酸氢钠熔融时的电离方程式:NaHCO3?Na++HCO3- | |
| C. | 次氯酸的结构式:Cl-O-H | |
| D. | 过氧化氢的电子式: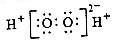 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
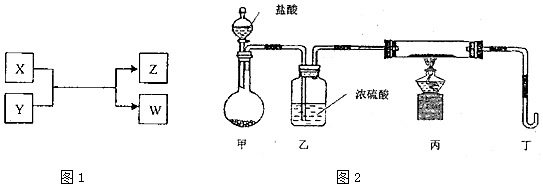
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com