
分析 根据价层电子对互斥理论确定分子构型、中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化,直线型;n=3,sp2杂化,无孤电子对为平面三角形、1个孤电子对V型;n=4,sp3杂化,分子构型2个孤电子对为V形、1个孤电子对三角锥形、无孤电子对正四面体型.分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:H2O中只含有单键为σ键,分子中O原子含有2个σ键电子对和孤电子对$\frac{6-1×2}{2}$=2个,杂化类型为sp3,分子构型为V型,从整个分子来看,电荷的分布是不均匀的,不对称的,属于极性分子;
三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,sp2杂化,不含孤电子对,所以为平面三角形结构,正负电荷重心重合,为非极性分子;
HCN结构式为H-C≡N,共价单键为σ键,共价三键中一个σ键、两个π键,所以该分子中含有2个σ键、2个π键;该分子中C原子价层电子对数=2+$\frac{4-1×4}{2}$=2,C原子杂化方式为sp,则HCN分子为直线形结构,正负电荷重心不重合,为极性分子;
CH4中价层电子对个数为4,孤电子对=$\frac{4-4×1}{2}$=0,价层电子对个数=4+0=4,杂化类型为sp3,则甲烷分子为正四面体形结构,正负电荷重心重合,为非极性分子;
故答案为:V型、sp3、极性;平面三角形、sp2、非极性;直线形、sp、极性;正四面体形;非极性.
点评 本题考查分子空间构型判断、分子极性判断,为高频考点,明确价层电子对互斥理论即可解答,难点是孤电子对计算方法以及分子构型判断,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
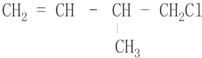
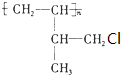 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此合金的熔点、硬度比镁和铝的熔点、硬度都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 比合金不能全部溶解于过量Fe2Cl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色.加入KSCN溶液后,溶液不变色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
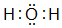 .
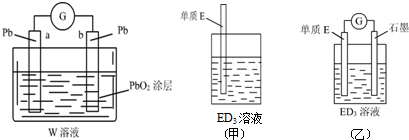
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是一种作用力 | |
| B. | 氢键也属化学键 | |
| C. | 化学键可以使离子相结合,也可以使原子相结合 | |
| D. | 化学方应过程中,反应物分子内的化学键断裂,生成物中的化学键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | KHCO3溶液与Al2(SO4)3溶液混合:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ | |
| C. | 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 碳酸电离:H2CO3=H++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com